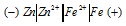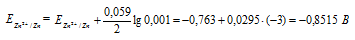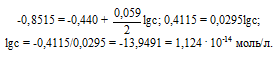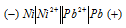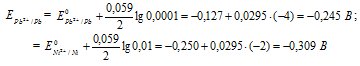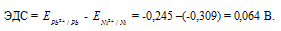- Химические процессы протекающие на электродах при зарядке и разрядке аккумулятора. Концентрация ионов на электродах
- Решение задач по химии на составление схемы аккумулятора
- Химическая реакция в аккумуляторе
- Процесс разрядки и зарядки АКБ
- На что влияет плотность электролита
- Улучшение свойств электролита
- Химические процессы протекающие на электродах при зарядке и разрядке аккумулятора. Концентрация ионов на электродах
- Решение задач по химии на составление схемы аккумулятора
Химические процессы протекающие на электродах при зарядке и разрядке аккумулятора. Концентрация ионов на электродах
Решение задач по химии на составление схемы аккумулятора
Задание 256.
Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было бы взять ионы железа (+2) (моль/л), чтобы ЭДС элемента стала равной нулю, если [Zn 2+ ] = 0,00 1 моль/л? Ответ: 7,3 моль/л.
Решение:
Цинк имеет меньший потенциал (-0,763 В) и является анодом, на котором протекает окислительный процесс:
Zn 0 — 2 
Железо, потенциал которого (-0,440 В) — катод, т.е. электрод, на котором протекает восстановительный процесс:
Fe 2+ + 2 
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
ЭДС гальванического элемента равна нулю, если электродные потенциалы электродов равны, следовательно, электродный потенциал железа численно равен электродному потенциалу цинка, т.е. равен -0,8515 В. Рассчитаем концентрацию ионов железа Fe 2+ , если электродный потенциал железного электрода равен -0,8515 В, получим:
Ответ: сFe 2+ = 1,124 . 10 -14 моль/л.
Задание 257.
Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению:
Ni + Pb(NO3)2 = Ni(NO3)2 + Рb
Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если [Pb 2+ ] = 0,0001 моль/л, [Ni] = 0,01 моль/л. Ответ: 0,064 В.
Решение:
Уравнение реакции имеет вид:
Из уравнения реакции вытекает, что никель является анодом, на котором протекает окислительный процесс:
Ni 0 — 2 
Свинец – катод, электрод на котором протекает восстановительный процесс:
Pb 2+ + 2 
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
Ответ: 0,064 В.
Задание 258.
Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора?
Решение:
В свинцовом аккумуляторе в качестве электролита используется раствор H2SO4 (p = 1,24-130 г/см 3 ). Электроды этого аккумулятора представляют свинцовые решётки. Решётки сначала заполняются оксидом свинца (IV) PbO2, который при взаимодействии с H2SO4 превращается в PbSO4. Сначала аккумулятор нужно зарядить. Суммарная реакция зарядки в аккумуляторе имеет вид:
2PbSO4 + 2H2O ⇔ Pb + PbO2 + 2H2SO4 (молекулярная форма);
2PbSO4 + 2H2O ⇔ Pb + PbO2 + 4H + + 2SO4 2- (ионно-молекулярная форма)
Электрохимические процессы при зарядке:
Анод: PbSO4 + 2H2O — 2 
Катод: PbSO4 + 2 
При разрядке свинцового аккумулятора протекает следующая химическая реакция:
Электрохимические процессы при разрядке аккумулятора:
Анод: Pb 2+ + SO4 2- — 2 
Катод: PbO2 + 4H + + SO4 2- + 2 
При разрядке аккумулятора:
К(+): PbO2 + 4H + + 2 
А(-): Pb 0 → Pb 2+ + 2
При зарядке аккумулятора:
К(+): Pb 2+ + 2 
А(-): Pb2+ + 2H2O → PbO2+4H + + 2
Задание 259.
Какие химические процессы протекают на электродах при зарядке и разрядке кадмий-никелевого аккумулятора?
Решение:
При зарядке аккумулятора:
А(+): Ni(OH)2 + OH — → NiOOH + H2O + 1 
К(-): Cd(OH)2 + 2 
При разрядке аккумулятора:
К(+): NiOOH + H2O + 1 
А(-): Cd + 2OH — → Cd(OH)2 + 2 
Задание 260.
Какие химические процессы протекают на электродах при зарядке и разрядке железо-никелевого аккумулятора?
Решение:
При зарядке аккумулятора:
А: Ni 2+ → Ni 3+ + 1 
К: Fe 2+ + 2 
При разрядке аккумулятора:
А: Fe 0 → Fe 2+ + 2 
К: Ni 3+ + 1 
Источник
Химическая реакция в аккумуляторе
Ток в АКБ создает химическая реакция между электролитом и материалом электродов. В стандартных кислотно-свинцовых батареях отрицательный электрод сделан из пористого свинца, а положительный – из диоксида свинца. Электролит представляет собой раствор серной кислоты.
Процесс разрядки и зарядки АКБ
Когда аккумулятор разряжается, между свинцом, диоксидом свинца и серной кислотой происходит реакция: PbO2 + Pb + 2H2SO4 → 2PbSO4 + 2H2O. В результате этого процесса ионы перемещаются от одного электрода к другому, образуя электрический ток. В ходе этого процесса серная кислота присоединяется к активной массе пластин в виде сульфата свинца. В ответ на это концентрация воды в электролите повышается, а, следовательно, его плотность снижается. Когда раствор будет состоять только из воды, реакция остановится, а аккумулятор перестанет вырабатывать ток.
Чтобы аккумулятор снова получил заряд, на электроды нужно подать напряжение. Так ионы начнут движение в обратном направлении, из-за чего кристаллическая решетка сульфата свинца начнет разрушаться, а концентрация серной кислоты увеличиваться. Эта химическая реакция выглядит так: 2PbSO4 + 2H2O → PbO2 + Pb + 2H2SO4. Она происходит в процессе зарядки аккумулятора.
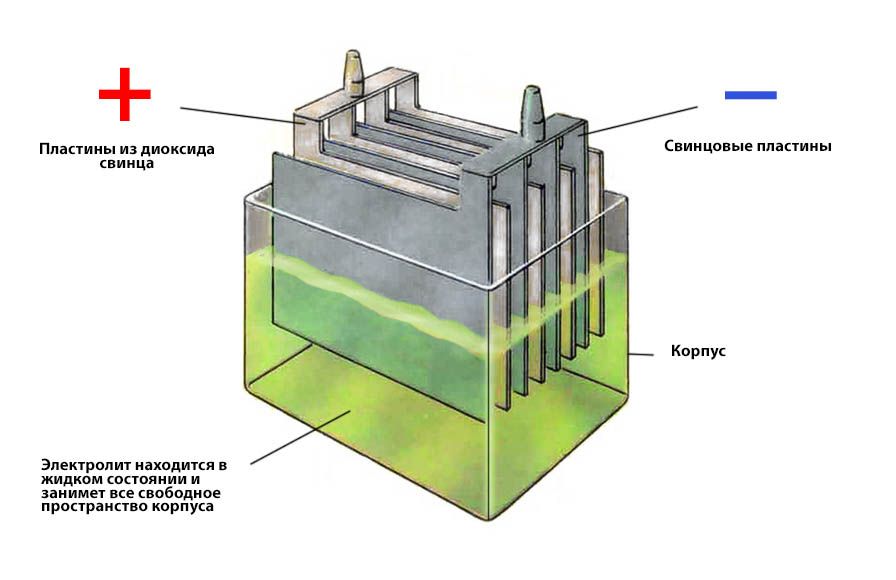
На что влияет плотность электролита
От состава электролита зависит емкость батареи. Чем выше изначальная концентрация серной кислоты, тем быстрее проходят все процессы в аккумуляторе, а концентрация сульфата на пластинах повышается. Происходит процесс сульфатации. Это явление негативно сказывается на работе батареи. При слишком высокой плотности также ускоряется коррозия пластин, в итоге, электрод разрушается и осыпается на дно батареи.
Улучшение свойств электролита
Производители постоянно повышают качества электролита. Создается замкнутая система вентиляции-конденсации, электролит помещается в волокнистый сепаратор или создается в форме геля. За счет этого удается не допустить расслоения электролита и испарения из него воды. Подобные технологии применяются в аккумуляторах бренда Mutlu. Они позволяют увеличить срок службы батареи и избавляют от необходимости регулярного обслуживания.
Источник
Химические процессы протекающие на электродах при зарядке и разрядке аккумулятора. Концентрация ионов на электродах
Решение задач по химии на составление схемы аккумулятора
Задание 256.
Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было бы взять ионы железа (+2) (моль/л), чтобы ЭДС элемента стала равной нулю, если [Zn 2+ ] = 0,00 1 моль/л? Ответ: 7,3 моль/л.
Решение:
Цинк имеет меньший потенциал (-0,763 В) и является анодом, на котором протекает окислительный процесс:
Zn 0 — 2 
Железо, потенциал которого (-0,440 В) — катод, т.е. электрод, на котором протекает восстановительный процесс:
Fe 2+ + 2 
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
ЭДС гальванического элемента равна нулю, если электродные потенциалы электродов равны, следовательно, электродный потенциал железа численно равен электродному потенциалу цинка, т.е. равен -0,8515 В. Рассчитаем концентрацию ионов железа Fe 2+ , если электродный потенциал железного электрода равен -0,8515 В, получим:
Ответ: сFe 2+ = 1,124 . 10 -14 моль/л.
Задание 257.
Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению:
Ni + Pb(NO3)2 = Ni(NO3)2 + Рb
Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если [Pb 2+ ] = 0,0001 моль/л, [Ni] = 0,01 моль/л. Ответ: 0,064 В.
Решение:
Уравнение реакции имеет вид:
Из уравнения реакции вытекает, что никель является анодом, на котором протекает окислительный процесс:
Ni 0 — 2 
Свинец – катод, электрод на котором протекает восстановительный процесс:
Pb 2+ + 2 
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
Ответ: 0,064 В.
Задание 258.
Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора?
Решение:
В свинцовом аккумуляторе в качестве электролита используется раствор H2SO4 (p = 1,24-130 г/см 3 ). Электроды этого аккумулятора представляют свинцовые решётки. Решётки сначала заполняются оксидом свинца (IV) PbO2, который при взаимодействии с H2SO4 превращается в PbSO4. Сначала аккумулятор нужно зарядить. Суммарная реакция зарядки в аккумуляторе имеет вид:
2PbSO4 + 2H2O ⇔ Pb + PbO2 + 2H2SO4 (молекулярная форма);
2PbSO4 + 2H2O ⇔ Pb + PbO2 + 4H + + 2SO4 2- (ионно-молекулярная форма)
Электрохимические процессы при зарядке:
Анод: PbSO4 + 2H2O — 2 
Катод: PbSO4 + 2 
При разрядке свинцового аккумулятора протекает следующая химическая реакция:
Электрохимические процессы при разрядке аккумулятора:
Анод: Pb 2+ + SO4 2- — 2 
Катод: PbO2 + 4H + + SO4 2- + 2 
При разрядке аккумулятора:
К(+): PbO2 + 4H + + 2 
А(-): Pb 0 → Pb 2+ + 2
При зарядке аккумулятора:
К(+): Pb 2+ + 2 
А(-): Pb2+ + 2H2O → PbO2+4H + + 2
Задание 259.
Какие химические процессы протекают на электродах при зарядке и разрядке кадмий-никелевого аккумулятора?
Решение:
При зарядке аккумулятора:
А(+): Ni(OH)2 + OH — → NiOOH + H2O + 1 
К(-): Cd(OH)2 + 2 
При разрядке аккумулятора:
К(+): NiOOH + H2O + 1 
А(-): Cd + 2OH — → Cd(OH)2 + 2 
Задание 260.
Какие химические процессы протекают на электродах при зарядке и разрядке железо-никелевого аккумулятора?
Решение:
При зарядке аккумулятора:
А: Ni 2+ → Ni 3+ + 1 
К: Fe 2+ + 2 
При разрядке аккумулятора:
А: Fe 0 → Fe 2+ + 2 
К: Ni 3+ + 1 
Источник