- Способы зарядки свинцово-кислотного аккумулятора
- Характеристики свинцово-кислотных аккумуляторов
- Что указывает на необходимость подзарядки
- Обязательные действия перед зарядкой
- Правила техники безопасности
- Методы зарядки
- Зарядка постоянным током
- Зарядка постоянным напряжением
- Комбинированный
- Зарядка в автоматическом режиме
- Каким может быть результат зарядки
- Действия после зарядки
- Химическая реакция в аккумуляторе
- Процесс разрядки и зарядки АКБ
- На что влияет плотность электролита
- Улучшение свойств электролита
- Уравнения химических процессов, протекающих на электродах свинцового аккумулятора
- Свойства элементов подгруппы ванадия, титана и хрома
Способы зарядки свинцово-кислотного аккумулятора
Рынок источников питания поражает своим изобилием и разнообразием автомобильных кислотных батарей (АКБ). Основное их отличие заключается в материале, из которого изготовлен электрод, и типе электролита.
Отсюда названия: литиевые, никель-кадмиевые, в том числе свинцово-кислотные и другие. Практически для каждой модели автомобиля существует свой тип АКБ.
Электролит бывает жидкий (водный раствор серной кислоты) или гелевый. В зависимости от этого источники питания разделяют на обслуживаемые и необслуживаемые.
Обслуживаемые требуют постоянного контроля за уровнем электролита способом своевременной добавки его или дистиллированной воды. Особенно важно проверить эти параметры перед зарядкой. В зависимости от времени года требуется доливать то или другое.
Свинцово-кислотные аккумуляторы относятся к обслуживаемым.
Характеристики свинцово-кислотных аккумуляторов

Свинцово-кислотные аккумуляторы очень популярны и пользуются спросом. Они имеют достаточно низкую стоимость и большой диапазон применения (кроме автомобилей, их можно встретить в бытовой технике, детских игрушках и др.).
Свинцово-кислотные аккумуляторы были известны уже в 60-е годы девятнадцатого века.
Металлические пластины данного аккумулятора покрываются свинцовым суриком. Это химически стойкое антикоррозийное покрытие служит защитой в агрессивной среде кислотного электролита.
Свинцово-кислотный аккумулятор отличается высокой удельной мощностью. За время эксплуатации допускает до 500 циклов перезарядки. Одним из существенных преимуществ является низкая цена.
Что указывает на необходимость подзарядки

При такой популярности следует всегда поддерживать свинцово-кислотные аккумуляторы в рабочем состоянии (впрочем, как и все другие).
А для этого требуется своевременная периодическое заряжение. О том, что такое время наступило, говорят очевидные факты: с трудом запускается двигатель, и значение напряжения опускается до 12 В.
Важно оперативно реагировать на те знаки, которые подает устройство. Если в такой ситуации продолжать использовать аккумулятор, он очень быстро станет неработоспособным без всякой надежды на восстановление.
Лучше чаще перезаряжать аккумулятор (это поможет продлить срок его службы).
Если свинцово-кислотный аккумулятор хорошего качества и приобретен из рук фирмы-изготовителя, частые перезарядки для него не только не опасны, а даже полезны, потому что тогда работа проходит без скачков напряжения.
На протяжении всей эксплуатации технические характеристики таких батарей остаются постоянными, если не доводить их до полного разряда. При отрицательной температуре это может привести еще к короткому замыканию.
Обязательные действия перед зарядкой

Большое влияние на процесс подзарядки имеет температурный режим. Прежде всего надо знать, что не рекомендуется заряжать свинцово-кислотную батарею при минусовой температуре. В зависимости от температуры требования к электролиту меняются.
При холодных погодных условиях важно сохранять плотность электролита, поэтому в это время нужно доливать именно его, а в летнее время – дистиллированную воду. Это касается обслуживаемых аккумуляторов.
Необслуживаемые батареи вынимаются из автомобиля и подключаются к зарядному устройству. Сам процесс происходит в автоматическом или полуавтоматическом режиме.
Важно выполнить несколько обязательных действий, которые являются подготовительными перед процессом подзарядки:
- прежде всего отсоединить аккумулятор, соблюдая осторожность;
- оставить в помещении с достаточной температурой, чтобы он нагрелся (в зимнее время) до требуемой по инструкции температуры;
- тщательно очистить электроды от окислов, образовавшихся в результате химической реакции;
- открутить пробки всех банок, чтобы исключить недопустимо высокого давления в корпусе;
- протереть от грязи весь корпус аккумулятора 10% раствором нашатырного спирта;
- проверить, требуется ли доливка дистиллированной воды;
- в случае необходимости – долить.
Все подготовительные операции завершены.
Правила техники безопасности

На всех этапах проведения зарядки — от подготовки до завершения работы — является обязательным соблюдение правил техники безопасности.
Это особенно важно для обслуживаемых АКБ, потому что это прежде всего связано с наличием серной кислоты, которая небезопасна, и в обращении с ней требуется дополнительная осторожность.
- Если невозможно изъять АКБ из автомобиля, следует отсоединить ее от отрицательного полюса или от обоих полюсов сразу.
- Чтобы избежать вытекания электролита, надо использовать для зарядки ровную устойчивую поверхность. Это требование не относится к необслуживаемым аккумуляторам, их положение может быть любым.
- Чтобы не допустить скопления газов в помещении и возможного отравления ими, помещение должно быть хорошо проветриваемым.
- Чтобы не произошло возгорание или взрыв, следует проводить работы удаленно от открытого огня или мест возможного искрения.
- Чтобы исключить нежелательные последствия, запрещается проводить зарядку при отрицательной температуре и температуре выше 30 °С.
Методы зарядки

Известны следующие методы зарядки:
- постоянным током;
- постоянным напряжением;
- комбинированный.
Во время зарядки необходима корректировка этих значений.
Зарядка постоянным током

Этот способ проводится строго под контролем и включает несколько этапов:
- АКБ подключается к зарядному устройству (ЗУ);
- задается ток силой 1/10 от номинального;
- зарядка длится несколько часов, потом прибором измеряется выходное напряжение;
- процесс останавливается, если значение составляет 14 В;
- снижается сила тока до 3 А (если значение было выше, например, 6 А), иначе возможно закипание;
- сила тока снижается снова, теперь уже до значения 1,5 А при достижении другого важного параметра — 15 В;
- процесс зарядки прекращается только тогда, когда два главных параметра перестают меняться и остаются неизменными.
Это медленный способ зарядки, он требует значительно большего времени.
Зарядка постоянным напряжением

Этот способ значительно проще. Позволяет зарядить устройство до 80-90% приблизительно за 6 часов. Значение изначально установленного напряжения составляет 14 В. Процесс протекает намного быстрее, чем при первом способе.
Комбинированный

Практически объединяет первые два способа. Но он значительно дороже, потому что в этом случае используется очень дорогое ЗУ.
Зарядка в автоматическом режиме

Самый простой режим. Применяется только для необслуживаемых батарей. Используется ЗУ, которое может автоматически настраиваться на тот тип аккумулятора, подключенного к нему.
По окончании процесса зарядное устройство самостоятельно отключается.
Каким может быть результат зарядки

Продолжительность процесса составляет от 6 часов (простой способ зарядки) до 24 часов. При минимальном проценте тока это может затянуться и на несколько дней.
Состояние аккумулятора в таком режиме напоминает «отдых» (разряженный аккумулятор хранится на складе при низкой температуре). Это говорит о том, что он быстро придет в негодность, потому что идет сульфатация.
После отключения от ЗУ после успешной зарядки внешний вид аккумулятора ничем не отличается от только что купленного.
При визуальном осмотре не должно быть обнаружено никаких следов налета или выделения сероводорода. Если налет присутствует, он указывает на то, что зарядка проводилась неправильно.
Обязательно нужно проверить сопротивление, если его значение повышается, значит с АКБ что-то не так: или в ней происходит разряд, или она не была заряжена полностью. И то, и другое указывает на неисправность и непригодность батареи.
В случае отсутствия явных признаков неработоспособности источника питания, его нужно проверить «в деле»: установить в машину и попробовать ее не только завести, но и проехать на какое-то расстояние при всех включенных приборах.
Если нет сбоев, значит все прошло и завершилось успешно.
Действия после зарядки
После отключения от ЗУ необходимо тщательно протереть крышку, корпус влажной тряпкой и просушить.
Если после этого измеренное напряжения превышает нуль, это говорит о том, что пропускается ток, и крышку необходимо дополнительно промыть содовым раствором.
Источник
Химическая реакция в аккумуляторе
Ток в АКБ создает химическая реакция между электролитом и материалом электродов. В стандартных кислотно-свинцовых батареях отрицательный электрод сделан из пористого свинца, а положительный – из диоксида свинца. Электролит представляет собой раствор серной кислоты.
Процесс разрядки и зарядки АКБ
Когда аккумулятор разряжается, между свинцом, диоксидом свинца и серной кислотой происходит реакция: PbO2 + Pb + 2H2SO4 → 2PbSO4 + 2H2O. В результате этого процесса ионы перемещаются от одного электрода к другому, образуя электрический ток. В ходе этого процесса серная кислота присоединяется к активной массе пластин в виде сульфата свинца. В ответ на это концентрация воды в электролите повышается, а, следовательно, его плотность снижается. Когда раствор будет состоять только из воды, реакция остановится, а аккумулятор перестанет вырабатывать ток.
Чтобы аккумулятор снова получил заряд, на электроды нужно подать напряжение. Так ионы начнут движение в обратном направлении, из-за чего кристаллическая решетка сульфата свинца начнет разрушаться, а концентрация серной кислоты увеличиваться. Эта химическая реакция выглядит так: 2PbSO4 + 2H2O → PbO2 + Pb + 2H2SO4. Она происходит в процессе зарядки аккумулятора.
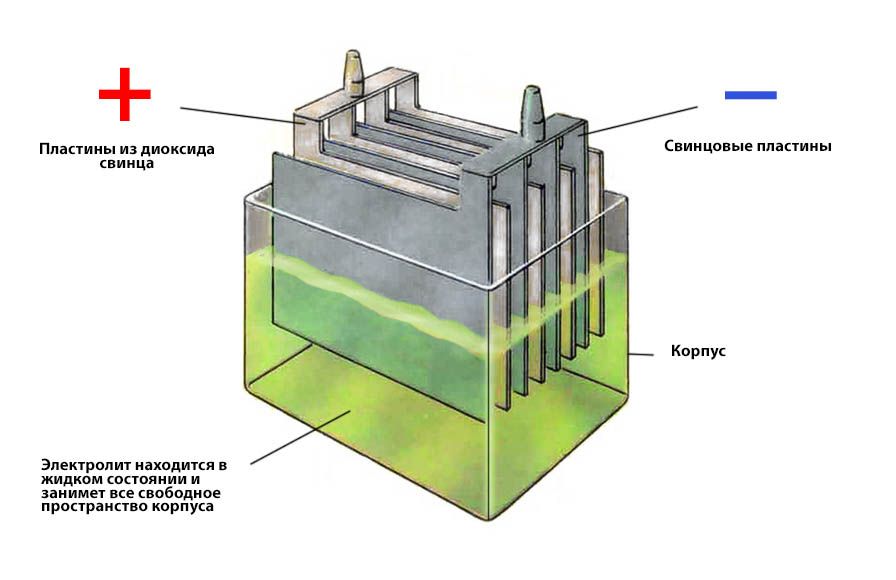
На что влияет плотность электролита
От состава электролита зависит емкость батареи. Чем выше изначальная концентрация серной кислоты, тем быстрее проходят все процессы в аккумуляторе, а концентрация сульфата на пластинах повышается. Происходит процесс сульфатации. Это явление негативно сказывается на работе батареи. При слишком высокой плотности также ускоряется коррозия пластин, в итоге, электрод разрушается и осыпается на дно батареи.
Улучшение свойств электролита
Производители постоянно повышают качества электролита. Создается замкнутая система вентиляции-конденсации, электролит помещается в волокнистый сепаратор или создается в форме геля. За счет этого удается не допустить расслоения электролита и испарения из него воды. Подобные технологии применяются в аккумуляторах бренда Mutlu. Они позволяют увеличить срок службы батареи и избавляют от необходимости регулярного обслуживания.
Источник
Уравнения химических процессов, протекающих на электродах свинцового аккумулятора
Задача 1080.
Написать уравнения реакций, протекающих на электродах свинцового аккумулятора при его заряде и разряде.
Решение:
а) В свинцовом аккумуляторе металлический свинец служит анодом и заряжён отрицательно, а PbO2 служит катодом и заряжён положительно. При работе аккумулятора – при его разряде – в нём протекает окислительно-восстановительный процесс, в ходе которого металлический свинец окисляется, а диоксид свинца – восстанавливается:
на аноде: Pb 0 — 2 
на катоде: PbO2 + 4H + + 2 
на аноде: Pb 0 + SO4 2- — 2 
на катоде: PbO2 + SO4 2- + 4H + + 2 
Суммарное уравнение реакции:
б) Для зарядки (или заряда) аккумулятор подключают к внешнему источнику тока (плюсом к плюсу и минусом к минусу). При этом ток протекает через аккумулятор в направлении обратном току, в котором он проходил при заряде аккумулятора. В результате этого электрохимические процессы обращаются. Свинцовый электрод теперь является катодом, а на электроде из диоксида свинца – становится анодом. При этом на электродах протекают следующие процессы:
на катоде: PbSO4 + 2 
на аноде: PbSO4 + H2O — 2 
Суммарное уравнение реакции:
Свойства элементов подгруппы ванадия, титана и хрома
Задача 1081.
Сравнить свойства элементов подгруппы ванадия со свойствами элементов: а) главной подгруппы V группы;
б) подгруппы титана; в) подгруппы хрома.
Решение:
а) Ванадий, ниобий, тантал – металлы, атомы которых содержат по 5 валентных электронов, которые расположеных на s-орбиталях внешнего и d-орбиталях предвнешнего слоя. Электронная конфигурация данных атомов должна иметь вид (n-1)d 3 ns 2 , но с учетом проскока одного электрона для Nb и Ta – (n-1)d 4 ns 1 . Имея в наружном электронном слое атома два или один электрон, эти элементы отличаются от элементов главной подгруппы (азота, фосфора и др.) преобладанием металлических свойств.
Химия ванадия напоминает химию подгруппы азота тем, что в степени окисления +5 ванадию соответствует кислота НVО3, гораздо более устойчивая, чем кислоты сурьмы и висмута — членов главной подгруппы. В то же время этот элемент образует простое вещество, которое, подобно другим членам побочной подгруппы, является типичным устойчивым тугоплавким металлом.
При сопоставлении элементов подгруппы ванадия с фосфором и азотом наблюдается резкое расхождение свойств производных низших валентностей и закономерный ход изменения характера высших окислов. Действительно, при переходе по ряду N2O5, Р2O5, V2О5, Nd2О5, Та2O5 кислотный характер окисла весьма последовательно ослабляется,
Напротив, очень похожие на N и Р в производных низших валентностей элементы подгруппы мышьяка уже не дают закономерного изменения химического характера высших окислов при переходе от N к Вi.
б) Титан — Ti, цирконий — Zr, гафний — Hf и курчатовий — Ku — полные электронные аналоги с общей электронной формулой (n-1)d 2 ns 2 . Содержат по 4 валентных электронов, которые расположены на s-орбиталях внешнего и d-орбиталях предвнешнего слоя.
Элементы группы ванадия и титана термически устойчивы, температуры плавления и кипения выше у металлов группы ванадия.
Кислотные свойства оксидов и гидроксидов более выражены у элементов группы ванадия, чем у элементов группы титана.
В присутствии окислителей ванадий, ниобий и тантал растворяются в щелочах. К растворам щелочей цирконий и гафний (в меньшей степени титан) устойчивы.
Ванадий при обычных условиях растворим в царской водке и концентрированной плавиковой кислоте. При нагревании растворим в азотной и концентрированной серной кислоте. Ниобий и тантал растворяются в смеси плавиковой и азотной кислоты. Титан при нагревании растворяется в соляной кислоте. Цирконий и гафний растворяются в кислотах, образуя устойчивые координационные соединения. Например, в плавиковой и концентрированной серной кислотах.
в) Элементы подгруппы хрома. Содержат по 6 валентных электронов, которые расположены на s-орбиталях внешнего и d-орбиталях предвнешнего слоя.
Кислотные свойства оксидов и гидроксидов более выражены у элементов группы хрома, чем у элементов группы ванадия.
Хром, молибден и вольфрам реагируют с расплавами щелочей, а ванадий, ниобий и тантал растворяются в щелочах.
В отличие от группы ванадия хром растворим в соляной и разбавленной серной кислотах. Концентрированные кислоты-окислители на холоду хром пассивируют. Молибден и вольфрам, как и ниобий с танталом растворяются только в смеси плавиковой и концентрированной азотной кислоты при нагревании.
Источник
