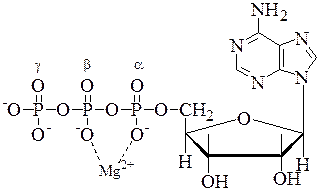Аккумуляторы энергии в организме
В ходе экзэргонических реакций (например, окислительных) выделяется энергия. Примерно 40-50% ее запасается в специальных аккумуляторах. Выделяют 3 основных аккумулятора энергии:
1. Внутренняя мембрана митохондрий – это промежуточный аккумулятор энергии при получении АТФ. За счет энергии окисления веществ происходит «выталкивание» протонов из матрикса в межмембранное пространство митохондрий. В результате создается электрохимический потенциал на внутренней мембране митохондрий. При разрядке мембраны энергия электрохимического потенциала трансформируется в энергию АТФ: Еокисл. ® Еэхп ® ЕАТФ. Для реализации этого механизма внутренняя мембрана митохондрий содержит ферментативную цепь переноса электронов на кислород и АТФ-синтазу (протонзависимую синтазу АТФ).
2. АТФ и другие макроэргические соединения. Материальным носителем свободной энергии в органических веществах являются химические связи между атомами. Обычным энергетическим уровнем возникновения или распада химической связи является
12,5 кДж/моль. Однако имеется ряд молекул, при гидролизе связей которых выделяется более 21 кДж/моль энергии (табл. 6.1). К ним относятся соединения с макроэргической фосфоангидридной связью (АТФ), а также ацилфосфаты (ацетил-фосфат, 1,3-БФГК), енол-фосфаты (фосфоенолпируват) и фосфогуанидины (фосфокреатин, фосфоаргинин).
Стандартная свободная энергия гидролиза некоторых фосфорилированных соединений
| Соединение | DG 0 ¢ (кДж/моль) |
| Фосфоенолпируват | -61,9 |
| 1,3-Бисфосфоглицерат | -49,4 |
| Ацетил-фосфат | -43,1 |
| Фосфокреатин | -43,1 |
| Пирофосфат (РРн) | -33,5 |
| АТФ (®АМФ+РРн) | -32,2 |
| АТФ (®АДФ+Рн) | -30,5 |
| Глюкозо-1-фосфат | -20,9 |
| Фруктозо-6-фосфат | -13,8 |
| Глюкозо-6-фосфат | -13,8 |
| Глицерол-3-фосфат | -9,2 |
Примечание: 1 ккал = 4,184 кДж
Основным макроэргическим соединением в организме человека является АТФ.
В АТФ цепочка из трех фосфатных остатков связана с 5’-ОН группой аденозина. Фосфатные группы обозначаются как a, b и g. Два остатка фосфорной кислоты соединены между собой фосфоангидридными связями, а a-остаток фосфорной кислоты – фосфоэфирной связью. При гидролизе АТФ в стандартных условиях выделяется -30,5 кДж/моль энергии.
При физиологических значениях рН АТФ несет четыре отрицательных заряда. Одной из причин относительной нестабильности фосфоангидридных связей является сильное отталкивание отрицательно заряженных атомов кислорода, которое ослабевает при гидролитическом отщеплении концевой фосфатной группы. Поэтому такие реакции являются высоко экзэргоническими.
В клетках АТФ находится в комплексе с ионами Mg 2+ или Mn 2+ , координационно связанными с a- и b-фосфатом, что увеличивает изменение свободной энергии при гидролизе АТФ до 52,5 кДж/моль.
Центральное место в приведенной шкале (табл. 9.1.) занимает цикл АТФ « АДФ + Рн. Это позволяет АТФ быть как универсальным аккумулятором, так и универсальным источником энергии для живых организмов. В клетках теплокровных АТФ как универсальный аккумулятор энергии возникает двумя путями:
1) аккумулирует энергию более энергоемких соединений, стоящих выше АТФ в термодинамической шкале без участия О2 – субстратноефосфорилирование: S
2) аккумулирует энергию электрохимического потенциала при разрядке внутренней мембраны митохондрии – окислительное фосфорилирование.
АТФ является универсальный источником энергии для совершения основных видов работы клетки (движение, трансмембранный перенос веществ, биосинтезы): а) АТФ + Н2О ® АДФ + Рн;
б) АTФ + Н2О ® АМФ + РРн. Во время интенсивных упражнений скорость использования АТФ может достигать 0,5 кг/мин. Если ферментативная реакция термодинамически невыгодна, то она может осуществиться при сопряжении с реакцией гидролиза АТФ. Гидролиз молекулы АТФ изменяет равновесное отношение субстратов и продуктов в сопряженной реакции в 10 8 раз.
К макроэргическим соединениям относят также нуклеозидтрифосфаты, которые обеспечивают энергией ряд биосинтезов: УТФ – углеводов; ЦТФ – липидов; ГТФ – белков. В биоэнергетике мышц важное место занимает креатинфосфат.
3. НАДФН+Н + (НАДФН2) – никотинамидадениндинуклеотидфосфат восстановленный. Это специальный аккумулятор с высокой энергией, который используется в клетке (цитозоль) для биосинтезов. R-CH3 + НАДФН2 + О2 ® R-CH2ОН + Н2О + НАДФ + (здесь показано создание ОН-группы в молекуле).
Освобождение энергии в живой клетке осуществляется постепенно, благодаря этому на различных этапах ее выделения она может аккумулироваться в удобной для клетки химической форме в виде АТФ. Различают три фазы, которые совпадают со стадиями катаболизма.
Первая фаза – подготовительная. На этой стадии происходит распад полимеров до мономеров в желудочно-кишечном тракте или внутри клеток. Освобождается до 1% энергии субстратов, которая рассеивается в виде тепла.
Вторая фаза – распад полимеров до общих промежуточных продуктов. Для нее характерно частичное (до 20%) освобождение энергии, заключенной в исходных субстратах. Часть этой энергии аккумулируется в фосфатных связях АТФ, а часть рассеивается в виде тепла.
Третья фаза – распад метаболитов до СО2 и Н2О с участием кислорода в митохондриях. Примерно 80% всей энергии химических связей веществ освобождается в данной фазе, которая сосредотачивается в фосфатных связях АТФ. Строение митохондрий:
1. Внешняя мембрана МХ отграничивает внутреннее пространство; проницаема для О2 и ряда низкомолекулярных веществ. Содержит ферменты метаболизма липидов и моноаминов.
2. Межмембранное пространство (ММП) содержит аденилаткиназу
(АТФ + АМФ « 2 АДФ) и ферменты фосфорилирования АДФ, не связанные с дыхательными цепями.
3. Внутренняя мембрана митохондрий (ВМП): 20-25% от всех белков составляют ферменты цепей переноса протонов и электронов и окислительного фосфорилирования. Проницаема лишь для малых молекул (О2, мочевина) и содержит специфические трансмембранные переносчики.
4. Матрикс содержит ферменты цикла трикарбоновых кислот,
b-окисления жирных кислот (основные поставщики субстратов окисления). Здесь находят ферменты автономного митохондриального синтеза ДНК, РНК, белков и др.
Существует мнение, что реально в клетках существует митохондриальный ретикулум, посредством которого формируется одна гигантская разветвленная митохондрия. При электронномикроскопическом анализе клеток выявляется общепринятая картина отдельных митохондрий, получаемая в результате поперечных срезов разветвленной структуры митохондрии. При гомогенизировании тканей выделяются отдельные митохондрии как результат замыкания разрушенных мембранных структур митохондрии. Единая для клетки мембранная структура митохондрии может служить для транспорта энергии в любые отделы клетки. Такие митохондрии обнаружены в клетках жгутиковых, дрожжей, ряда тканей (мышцы).
У бактерий митохондрий нет, аэробное окисление и образование АТФ протекают в цитоплазматической мембране в особых мембранных образованиях – мезосомах. Мезосомы представлены двумя основными формами – ламмелярной и везикулярной.
В основе биологического окисления лежат окислительно-восстановительные процессы, определяемые переносом электронов. Вещество окисляется, если теряет электроны или одновременно электроны и протоны (водородные атомы, дегидрирование) или присоединяет кислород (оксигенирование). Противоположные превращения – восстановление.
Способность молекул отдавать электроны другой молекуле определяется окислительно-восстановительным потенциалом (редокс-потенциалом, Е 0 ¢, или ОВП). Редокс-потенциал определяют путем измерения электродвижущей силы в вольтах. В качестве стандарта принят редокс-потенциал реакции при рН 7,0: Н2 « 2Н + + 2е — , равный — 0,42 В. Чем меньше потенциал окислительно-восстановительной системы, тем легче она отдает электроны и в большей степени является восстановителем. Чем выше потенциал системы, тем сильнее выражены ее окислительные свойства, т.е. способность принимать электроны. Это правило лежит в основе последовательности расположения промежуточных переносчиков электронов от водородов субстратов до кислорода от НАДН (-0,32 В) до кислорода (+0,82 В).
При изучении окислительных процессов в клетках целесообразно придерживаться следующей схемы использования кислорода (табл. 6.2). Здесь рассматриваются три основных пути: 1) окисление субстрата путем дегидрирования с переносом двух атомов водорода на атом кислорода с образованием Н2О (энергия окисления аккумулируется в форме АТФ, на этот процесс расходуется более 90% кислорода) или молекулу кислорода с образованием Н2О2; 2) присоединение атома кислорода с образованием гидроксильной группы (повышение растворимости субстрата) или молекулы кислорода (метаболизм и обезвреживание устойчивых ароматических молекул); 3) образование кислородных свободных радикалов, служащих как для защиты внутренней среды организма от чужеродных макромолекул, так и для повреждения мембран в механизмах окислительного стресса. Тканевое дыхание–часть биологического окисления, при котором происходит дегидрирование и декарбоксилирование субстратов с последующим переносом протонов и электронов на кислород и выделением энергии в виде АТФ.
Основные пути использования кислорода в клетках
| ОКИСЛЕНИЕ СУБСТРАТА (R) | ||||
| Дегидрирование | Оксигенирование | Свободно-радикальное окисление | ||
| -2Н | -2Н | +½ О2 | +О2 | О2¯· НО· NО∙ ONOO- озон |
| на ½ О2 | на О2 | |||
| Н2О | Н2О2 | R-OH | RO2 | |
| Тканевое дыхание | Простые окислительные системы | Монооксиге- назный путь | Диоксиге- назный путь | |
| АТФ | Обезвреживание | Обезвреживание | Разрыв ароматических колец | |
| Тепло | Тепло |
Субстраты окисления – это молекулы, которые при окислении дегидрируются (теряют 2 Н). В основе классификации лежит представление о том, что стандартная свободная энергия окисления НАДН составляет DG 0 ¢ = -218 кДж/моль. В связи с этой величиной различают 3 вида субстратов:
1. Субстраты I рода (углеводородные) – сукцинат, ацил-КоА.
При их дегидрировании образуются непредельные соединения. Средняя энергия отщепления пары е — около 150 кДж/моль; НАД не может участвовать в дегидрировании субстратов I рода.
2. Субстраты II рода (спиртовые) – изоцитрат, малат. При их дегидрировании возникают кетоны. Средняя энергия отщепления пары е — около 200 кДж/моль, поэтому НАД может участвовать в дегидрировании субстратов II рода.
3. Субстраты III рода (альдегиды и кетоны) – глицеральдегид-3-фосфат, а также пируват и 2-оксоглутарат.
Энергия отщепления пары е — около 250 кДж/моль. Дегидрогеназы субстратов III рода часто содержат несколько коферментов. При этом часть энергии запасается до цепи переноса электронов.
В зависимости от типа субстрата окисления (т.е. от энергии отщепления пары е — ) выделяют полную и укороченную дыхательные цепи (цепи переноса электронов, ЦПЭ). ЦПЭ – это универсальный конвейер по переносу электронов от субстратов окисления к кислороду, построенный в соответствии с градиентом окислительно-восстановительного потенциала. Главные компоненты дыхательной цепи расположены в порядке возрастания их окислительно-восстановительного потенциала. В полную ЦПЭ вступают субстраты II и III рода, в укороченную – субстраты I рода. ЦПЭ встроена во внутреннюю мембрану митохондрий. Атомы водорода или электроны перемещаются по цепи от более электроотрицательных компонентов к более электроположительному кислороду.
Дата добавления: 2015-06-12 ; просмотров: 6080 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
«АТФ – универсальный аккумулятор и переносчик энергии в живом организме».
«АТФ – универсальный аккумулятор и переносчик энергии в живом организме».
Такое краткое и точное определение приводят учебники биохимии. Специфические энергетические и уникальные универсальные функции в живых организмах АТФ выполняет благодаря своим «потребительским качествам» – химическим свойствам. Она хорошо растворима и легко подвергается гидролизу (с помощью ферментов в нужное время и в нужном месте), может накапливаться (в относительно большой концентрации) в клетках, удерживая при этом свободную энергию.
Специфические энергетические функции АТФ, которые она выполняет в любом живом организме на Земле, – «посредничество» в энергетических операциях в клетке. С одной стороны процесса обмена веществ (это на стороне анаболизма) при своем образовании (синтезе из АМФ и H2PO4- или АДФ и HPO4-2) АТФ в макроэргических фосфатных связях аккумулирует свободную энергию, выделяющуюся в ходе реакций биологического окисления. С другой стороны, того же обмена веществ (на стороне катаболизма), АТФ при своем распаде высвобождает исходную АДФ (или АМФ) и передает фосфатный остаток HPO4-2 (или H2PO4-) вместе с «локально» аккумулированной на нем «порцией» свободной энергии в энергозатратную реакцию биологического синтеза.
АТФ + Н2О ? АДФ + Фнеорг +30 кДж/моль
АДФ + Н2О ? АМФ + Фнеорг +30 кДж/моль
Подвижность и возможность превращения свободной энергии химических связей АТФ в электрический потенциал ??H+ (на мембранах митохондрий) позволяет этому соединению выполнять уникальную функцию – «конвертирование» – превращение одной формы энергии в другую, причем эквивалентное. АТФ – уникальный, подвижный клеточный «обменник» свободной энергии. Именно это свойство позволило эволюции изобрести «механику» живых систем, в основе которой – мышечное сокращение (перемещение на молекулярном – микро- и передвижение на макро уровне).
Использовать разность потенциалов ??H+ для практических нужд научились еще бактерии: они перемещаются, вращая жгутиками (или фибриллами как бледные спирохеты – возбудители сифилиса). Но только изобретение эволюцией (и соответствующее «генетическое патентование») мышечного волокна, в котором осуществляется преобразование энергии химических связей АТФ в разность потенциалов ??H+ и далее в механическую работу обеспечило живым организмам – макросистемам огромные возможности скоростного перемещения в пространстве: полет, плавание, прыжки, бег и все возможные виды спорта.
Источник