- Принцип работы свинцово-кислотного аккумулятора
- Общая информация
- Принцип работы и виды
- Емкость и напряжение
- Эксплуатация и восстановление
- Свинцово-кислотный аккумулятор
- Содержание
- История
- Принцип действия
- Устройство
- Физические характеристики
- Эксплуатационные характеристики
- Эксплуатация
- Свинцово-кислотный аккумулятор при низких температурах
- Хранение
- Износ свинцово-кислотных аккумуляторов
- Вторичная переработка
- См. также
- Примечания
- Ссылки
- Смотреть что такое «Свинцово-кислотный аккумулятор» в других словарях:
Принцип работы свинцово-кислотного аккумулятора
Свинцово-кислотный аккумулятор — один из самых распространенных типов батарей, использующийся в качестве источника электроэнергии для автомобиля, мотоцикла, мопеда, или в случае необходимости создания запасных источников питания.
Общая информация
Первая модель свинцово-кислотного аккумулятора была создана в середине XIX века ученым Гастоном Планте. Тогда его конструкция подразумевала две свинцовых пластины, стеклянную колбу с серной кислотой и обычное полотно в роли сепаратора. Это устройство обладало малой емкостью заряда и не получило достаточного распространения. Но идею оценили другие ученые и стали экспериментировать с составом электродов. В итоге самой удачной оказалась решетчатая конструкция из сплава с добавлением сурьмы. Изобретение генераторов постоянного тока решило проблему с подходящим источником энергии, и свинцово-кислотные аккумуляторные батареи наконец-таки получили широкое распространение.
В конце ХХ века их конструкция усложнилась, появились необслуживаемые аккумуляторы, в электроды которых был добавлен кальций. Это нововведение позволило существенно сократить расход воды. В идеале, батареи такого типа способны работать без пополнения количества воды в электролите весь срок службы. Кстати, при необходимости утратившее работоспособность устройство можно попробовать восстановить, используя принцип действия кислотных аккумуляторов.
Принцип работы и виды
Кислотные аккумуляторы — вторичные источники тока, который образуется за счет реакций восстановления и окисления, проходящих между материалом электродов и электролитом. В качестве электролита используется водный раствор серной кислоты. Остановимся на подробнее на устройстве аккумуляторов этого типа.
По конструктивным особенностям современные батареи делятся на три типа:
- С жидким электролитом. Могут быть как обслуживаемыми, так и необслуживаемыми. Электролит — смесь серной кислоты и воды, находящаяся в жидком виде. В версии, требующей обслуживания, пластины изготавливаются из свинца с добавлением сурьмы и мышьяка. В таких батареях высок расход воды, что делает обслуживание аккумулятора не очень простой задачей. После замены сурьмы на кальций в состав сплава отрицательной пластины появились так называемые гибридные аккумуляторы, более удобные в эксплуатации, чем их предшественники. И, наконец, с добавлением кальция в обе пластины началась эра устройств, не требующих восстановления количества воды весь срок службы. Несмотря на совершенство конструкции, у них есть один минус — плохо переносят почти полный разряд, особенно в условиях отрицательной температуры.
- Гелевые АКБ. В этих конструкциях электролит находится в сгущенном состоянии благодаря добавлению кремния. Плюс такой конструкции в том, что батарея становится абсолютно герметичной. Газ, выделяющийся в процессе химических реакций, находит себе место в порах геля, а при обратных реакциях вновь присоединяется к раствору серной кислоты. Но это очень капризные батареи. Они требуют неукоснительного соблюдения условий эксплуатации, чувствительны к перепадам температур, справляются с высокой нагрузкой хуже, чем их жидкостные собратья. Но они хорошо справляются с сильной разрядкой, действительно не требуют дополнительного обслуживания. Гелевые АКБ чаще используются в качестве стационарно резервного источника питания и редко устанавливаются на транспорт.
- AGM-аккумуляторы. Это самый современный вид батарей, сочетающий все достоинства предыдущих вариантов. Электролит остается жидким, но циркулирует в пористой конструкции из тончайших стеклянных волокон. Два вида пор — большие и маленькие — обеспечивают свободное перемещение газа до того, как запустится обратная реакция. Конструкция устройства такова, что аккумулятор может работать, даже если его оболочка незначительно повреждена. Не боятся они и холода, глубокой разрядки, вибраций. Единственная уязвимость такого устройства — чувствительность к перепадам напряжения. Эту проблему можно решить, контролируя работу генератора и пользуясь надежным ЗУ.
Емкость и напряжение
У любого вида аккумулятора есть два основных параметра: емкость и напряжение. Емкость определяет количество энергии, которое аккумулятор может отдать при рабочем напряжении, измеряется в Ампер-часах. Она зависит от площади свинцовых пластин, участвующих в химических реакциях. При износе аккумулятора его емкость уменьшается из-за естественных потерь в размере пластин.
Напряжение — количество электрического тока, отдаваемое батареей. Измеряется в вольтах, зависит от плотности электролита. Оба параметра необходимо контролировать, так как от них зависит работоспособность устройства.
Для измерения напряжения используется вольтмер, правильные показатели — от 11 до 13 вольт (раньше производились аккумуляторы с напряжением 6 вольт, теперь они считаются устаревшими).
Чтобы измерить емкость, существует несколько методов:
- «Нагрузочная вилка» — измерение напряжения при эталонной нагрузке. Аккумулятор должен быть полностью заряжен.
- Специальный индикатор, способный посылать сигнал, определяющий площадь свинцовых пластин, и преобразовывать его в цифры. Не требует особых условий использования.
- В домашних условиях можно подключить мощную автомобильную галогеновую лампу и замерить в это время напряжение. Ели в течение 2 минут оно держится на уровне
11 вольт, а свет лампы ровный и сильный — все в порядке.
Эксплуатация и восстановление
В зависимости от типа используемого аккумулятора, условия его эксплуатации будут сильно отличаться. Единственная общая черта — всех их необходимо вовремя заряжать. Так, обслуживаемая батарея требует долива воды в аккумулятор, что может представлять собой опасность — кислота нагревает воду, и кипяток может ощутимо обжечь автовладельца.
Конструкция необслуживаемых аккумуляторов не предполагает возможности пополнения запаса воды в них. Но, даже если произвести небольшие изменения в конструкции, обжечься кипятком все равно будет проблематично. Для батарей такого типа важно не допускать больших колебаний напряжения. Это справедливо и для автомобильного, и для мотоциклетного аккумулятора. Но герметичный корпус уменьшает варианты восстановления устройства.
Как восстановить батарею? Часто снижение емкости или напряжения аккумулятора происходит из-за того, что некоторые участки электролита слишком уплотнились. При многоразовой небольшой зарядке эти области разжижаются, и потенциал устройства восстанавливается. Существует несколько рецептов восстанавливающего раствора, который несколько улучшает состояние устройства. К сожалению, его использование несколько затруднено на батареях с герметизированным корпусом, так как слить из него этот раствор будет проблематично.
Какой бы аккумулятор ни был установлен на транспортном средстве, важно соблюдать инструкцию по его использованию, вовремя заряжать и, при необходимости, пополнять запас воды в электролите. Тогда срок службы батареи будет максимально долгим.
Источник
Свинцово-кислотный аккумулятор
Свинцово-кислотный аккумулятор — наиболее распространенный на сегодняшний день тип аккумуляторов, изобретен в 1859 году французским физиком Гастоном Планте. Основные области применения: аккумуляторные батареи в автомобильном транспорте, аварийные источники электроэнергии.
Содержание
История
Свинцовый аккумулятор разработал в 1859—1860 годах Гастон Планте, сотрудник лаборатории Александра Беккереля. В 1878 году Камилл Фор усовершенствовал его конструкцию, покрыв пластины аккумулятора свинцовым суриком.
Принцип действия
Принцип работы свинцово-кислотных аккумуляторов основан на электрохимических реакциях свинца и диоксида свинца в сернокислотной среде.
Энергия возникает в результате взаимодействия оксида свинца и серной кислоты до сульфата (классическая версия). Проведенные в СССР исследования показали, что внутри свинцового аккумулятора протекает как минимум
60 реакций, порядка 20 из которых протекают без участия кислоты электролита (нехимические) [1]
Во время разряда происходит восстановление диоксида свинца на катоде [2] [1] и окисление свинца на аноде. При заряде протекают обратные реакции, к которым в конце заряда добавляется реакция электролиза воды, сопровождающаяся выделением кислорода на положительном электроде и водорода — на отрицательном.
Химическая реакция (слева направо — разряд, справа налево — заряд):
- Анод:
- Катод:
В итоге получается, что при разряде аккумулятора расходуется серная кислота из электролита (и плотность электролита падает, а при заряде, серная кислота выделяется в раствор электролита из сульфатов, плотность электролита растёт). В конце заряда, при некоторых критических значениях концентрации сульфата свинца у электродов, начинает преобладать процесс электролиза воды. При этом на катоде выделяется водород, на аноде — кислород. При заряде не стоит допускать электролиза воды, в противном случае необходимо её долить для восполнения потерянного в ходе электролиза количества.
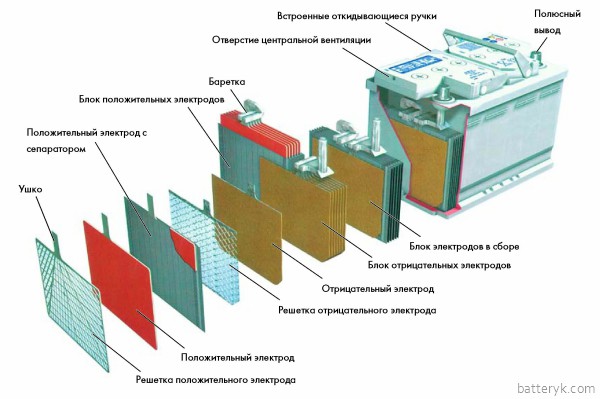
Устройство
Элемент свинцово-кислотного аккумулятора состоит из электродов (положительных и отрицательных) и разделительных изоляторов (сепараторов), которые погружены в электролит. Электроды представляют собой свинцовые решётки. У положительных активным веществом является перекись свинца (PbO2), у отрицательных активным веществом является губчатый свинец.
На самом деле электроды выполнены не из чистого свинца, а из сплава с добавлением сурьмы в количестве 1-2 % для повышения прочности и примесей. Иногда в качестве легирующего компонента используются соли кальция, в обеих пластинах, или только в положительных. Применение солей кальция вносит не только положительные но и много отрицательных моментов в эксплуатацию свинцового аккумулятора, например, у такого аккумулятора при глубоких разрядах существенно и необратимо снижается емкость.
Электроды погружены в электролит, состоящий из разбавленной дистиллированной водой серной кислоты (H2SO4). Наибольшая проводимость этого раствора наблюдается при комнатной температуре (что означает наименьшее внутреннее сопротивление и наименьшие внутренние потери) и при его плотности 1,23 г/см³
Однако на практике, часто в районах с холодным климатом применяются и более высокие концентрации серной кислоты, до 1,29 −1,31 г/см³.
Существуют экспериментальные разработки аккумуляторов где свинцовые решетки заменяют вспененным карбоном, покрытым тонкой свинцовой пленкой. Используя меньшее количество свинца и распределив его по большой площади, батарею удалось сделать не только компактной и легкой, но и значительно более эффективной — помимо большего КПД, она заряжается значительно быстрее традиционных аккумуляторов. [3]
В батареях для бытовых ИБП жидкий электролит сгущают водным щелочным раствором силикатов натрия (Na2Si2O4)жидкое стекло до пастообразного состояния.
Физические характеристики
- Теоретическая энергоёмкость (Вт·ч/кг): около 133.
- Удельная энергоёмкость (Вт·ч/кг): 30-60.
- Теоретическая удельная энергоплотность (Вт·ч/дм³): 1250. [4]
- ЭДС заряжённого аккумулятора = 2,11 — 2,17 В, рабочее напряжение = 2 В (3 или 6 секций в итоге дают стандартные 6 В или 12 В (12 В)). [1]
- Напряжение полностью разряженного аккумулятора = 1,75 — 1,8 В (из расчета на 1 секцию). Ниже разряжать их нельзя. [1]
- Рабочая температура: от −40 °C до +40 °C.
- КПД: порядка 80-90 %
Эксплуатационные характеристики
- Номинальная ёмкость, показывает количество электричества, которое может отдать данный аккумулятор. Обычно указывается в ампер-часах, и измеряется при разряде [5] малым током (1/20 номинальной емкости, выраженной в А*ч).
- Стартерный ток (для автомобильных аккумуляторов). Характеризует способности отдавать сильные токи при низких температурах. В большинстве случаев замеряется при −18 °C (0 °F) в течение 30 секунд. Различные методики [6] замера отличаются, главным образом, допускаемым конечным напряжением.
- Резервная емкость (для автомобильных аккумуляторов). Характеризует время, в течение которого аккумулятор может отдавать ток 25А до конечного напряжения 10,5В согласно ГОСТ Р 53165-2008 [7] .
Эксплуатация
При эксплуатации «обслуживаемых» аккумуляторов (с открываемыми крышками над банками) на автомобиле при движении по неровностям неизбежно происходит просачивание проводящего электролита на корпус аккумулятора. Во избежание сильного саморазряда необходимо периодически нейтрализовывать электролит протиранием корпуса, например слабым раствором пищевой соды или разведенным в воде до состояния консистенции жидкой сметаны хозяйственным мылом. Кроме того, особенно в жаркую погоду, происходит испарение воды из электролита, что увеличивает его плотность, увеличивая напряжение на аккумуляторе, и может оголить свинцовые пластины. Поэтому необходимо следить за уровнем электролита и своевременно доливать дистиллированную воду.
Такие нехитрые операции вместе с проверкой автомобиля на утечку тока и периодической подзарядкой аккумулятора могут на несколько лет продлить срок эксплуатации батареи.
Свинцово-кислотный аккумулятор при низких температурах
По мере снижения окружающей температуры, параметры аккумулятора ухудшаются, однако в отличие от прочих типов аккумуляторов, свинцово-кислотные снижают их относительно медленно, что не в последнюю очередь обусловило их широкое применение на транспорте. Считается что свинцово-кислотный аккумулятор теряет
1% ёмкости на каждый градус от +20°C. Т.е. в -30°C свинцово-кислотный аккумулятор будет иметь 50% ёмкости.
Снижение ёмкости и токоотдачи при низких температурах обусловлено, в первую очередь, ростом вязкости электролита, который уже не может в полном объёме поступать к электродам, и вступает в реакцию лишь в непосредственной близости от них, быстро истощаясь.
Не полностью заряженный аккумулятор в мороз может раздуться из-за замерзания электролита низкой плотности (близкой к 1.10)
Хранение
Свинцово-кислотные аккумуляторы необходимо хранить только в заряжённом состоянии. При температуре ниже −20 °C заряд аккумуляторов должен проводиться постоянным напряжением 2,45 В/секцию 1 раз в год в течение 48 часов. При комнатной температуре — 1 раз в 8 месяцев постоянным напряжением 2,35 В/секцию в течение 6-12 часов. Хранение аккумуляторов при температуре выше 30 °C не рекомендуется.
Слой грязи и накипи на поверхности аккумулятора создаёт проводник для тока от одного контакта к другому и приводит к саморазряду аккумулятора,после чего начинается преждевременная сульфатизация пластин и поэтому поверхность аккумулятора необходимо поддерживать в чистоте. Хранение свинцово-кислотных аккумуляторов в разряженном состоянии приводит к быстрой потере их работоспособности.
При длительном хранении аккумуляторов и разряде их большими токами (в стартерном режиме), или при уменьшении ёмкости аккумуляторов, нужно проводить контрольно-тренировочные циклы, то есть разряд-заряд токами номинальной величины.
Износ свинцово-кислотных аккумуляторов
При использовании технической серной кислоты и не дистиллированной воды, ускоряются саморазряд, сульфатация, разрушение пластин и уменьшение ёмкости аккумуляторной батареи. [8]
В результате каждой реакции образуется нерастворимое вещество — сернокислый свинец PbSO4, осаждающийся на пластинах, который образует диэлектрический слой между токоотводами и активной массой. Это один из факторов, влияющий на срок службы свинцово-кислотной аккумуляторной батареи.
Основными процессами износа свинцово-кислотных аккумуляторов являются:
- сульфатация пластин [1] , заключающаяся в образовании крупных кристаллитов сульфата свинца, который препятствует протеканию обратимых токообразующих процессов;
- коррозия электродов, то есть электрохимические процессы окисления и растворения в электролите, что вызывает осыпание материала электродов;
- слабая механическая прочность или плохое сцепление активной массы с токоотводами, что приводит к опаданию активной массы; [9][1]
- оползание и осыпание активной массы положительных электродов, связанное с разрыхлением, нарушением однородности. [1]
Хотя батарею, вышедшую из строя по причине физического разрушения пластин, самому починить нельзя, некоторые источники описывают химические растворы и прочие способы способные «десульфатировать» пластины. Простой но вредный для жизни аккумулятора способ предполагает использование раствора сульфата магния. [1] Раствор заливается в секции после чего батарею разряжают и заряжают несколько раз. Сульфат свинца и прочие остатки химической реакции осыпаются при этом на дно батареи, что может привести к замыканию секции поэтому обработанные секции желательно промыть и заполнить новым электролитом номинальной плотности. Это позволяет несколько продлить срок использования устройства. Если батарея имеет одну или несколько секций которые не работают (то есть не дают 2.17 вольта — например если корпус имеет трещины) возможно соединить две (или больше) батареи последовательно: к плюсовому контакту первой батареи подключаем плюсовой провод потребителя, к минусовому контакту второй батареи — минусовой провод потребителя, а две оставшихся контакта батареи соединяются кабелем. Такая батарея имеет суммарное напряжение работающих секций и поэтому количество работающих секций должно быть не более шести — то есть необходимо слить электролит из излишних секций. Такой вариант подходит для транспортных средств с большим моторным отсеком.
Вторичная переработка
Вторичная переработка для этого вида аккумуляторов играет важную роль, так как свинец, содержащийся в аккумуляторах является тяжелым металлом и наносит серьёзный вред при попадании в окружающую среду. Свинец и его соли должны быть переработаны на специальных предприятиях для возможности его вторичного использования.
Выброшенные аккумуляторы часто используются как источник свинца для кустарной переплавки, например, в рыболовные грузила, дробь или гири. Для этого из аккумулятора сливается электролит, остатки нейтрализуются промыванием каким-либо безвредным основанием (например, гидрокарбонатом натрия), после чего корпус батареи разбивается и извлекается металлический свинец.
См. также
Примечания
- ↑ 12345678Свинцовые аккумуляторы. Эксплуатация: Правда и вымыслы.
- ↑Н. Ламтев. Самодельные аккумуляторы. Москва: Государственное издательство по вопросам радио, 1936 год.
- ↑http://auto.lenta.ru/news/2006/12/19/battery/ Американцы облегчили и уменьшили аккумуляторы
- ↑Расчет идеального свинцового аккумулятора.
- ↑ГОСТ 26881-86 Методика проверки свинцовых АКБ
- ↑Краткий аналитический обзор существующих способов оценки емкости ХИТ и приборов, реализующих эти способы
- ↑ГОСТ Р 53165-2008: Батареи аккумуляторные свинцовые стартерные для автотракторной техники. Общие технические условия
- ↑Вредные добавки к электролиту свинцовых аккумуляторов
- ↑О противоречиях в теории работы свинцового кислотного аккумулятора к. т. н., проф. Кочуров А. А. Рязанский военный автомобильный институт
Ссылки
- ГОСТ 15596-82 Источники тока химические. Термины и определения
- ГОСТ Р 53165-2008 Батареи аккумуляторные свинцовые стартерные для автотракторной техники. Общие технические условия. Взамен ГОСТ 959—2002 и ГОСТ 29111-91
- О противоречиях в теории работы свинцового кислотного аккумулятора к. т. н., проф. Кочуров А. А. Рязанский военный автомобильный институт
- Видео, демонстрирующее принцип работы аккумулятора на YouTube
- Форум «Электротранспорт.ру»
- Обслуживание и Восстановление свинцовых АКБ системы AGM»
 Химические источники тока Химические источники тока | |
|---|---|
| Гальванический элемент | Гальванический элемент Даниеля | Щелочной элемент | Ртутно-цинковый элемент | Сухой элемент | Концентрационный элемент | Воздушно-цинковый элемент | Нормальный элемент Вестона |
| Электрические аккумуляторы | Свинцово-кислотный | Серебряно-цинковый | Никель-кадмиевый | Никель-металл-гидридный | Никель-цинковый аккумулятор | Литий-ионный | Литий-полимерный | Литий-железо-сульфидный | Литий-железо-фосфатный | Литий-титанатный | Ванадиевый | Железо-никелевый |
| Топливные элементы | Прямой метанольный | Твердооксидный | Щелочной |
| Модели | Батарея | Электрический аккумулятор | Топливный элемент |
| Устройство | Анод | Катод | Электролит |
Wikimedia Foundation . 2010 .
Смотреть что такое «Свинцово-кислотный аккумулятор» в других словарях:
Аккумулятор (значения) — Аккумулятор (лат. accumulator собиратель, от лат. accumulo собираю, накопляю) устройство для накопления энергии с целью её последующего использования. Автомобильный аккумулятор аккумуляторная батарея, используемая на автомобильном… … Википедия
аккумулятор — 1.3.7. аккумулятор : Устройство, представляющее собой источник электрической энергии, полученной путем прямого преобразования химической энергии, состоящее из электродов, сепараторов, электролита, корпуса и выводов и сконструированное так, чтобы… … Словарь-справочник терминов нормативно-технической документации
аккумулятор типа С — 3.9 аккумулятор типа С: Стационарный свинцово кислотный аккумулятор открытого типа. Источник: СТО Газпром 2 6.2 086 2006: Методика по техническому диагностированию систем постоянного тока энергохозяйства ОАО … Словарь-справочник терминов нормативно-технической документации
аккумулятор типа СК — 3.10 аккумулятор типа СК: Стационарный свинцово кислотный аккумулятор. Рассчитан и на короткий разряд от 1 до 2 часов. Источник: СТО Газпром 2 6.2 086 2006: Методика по техническому диагностированию систем п … Словарь-справочник терминов нормативно-технической документации
аккумулятор типа СН — 3.11 аккумулятор типа СН: Стационарный свинцово кислотный аккумулятор с намазанными электродными пластинами. Источник: СТО Газпром 2 6.2 086 2006: Методика по техническому диагностированию систем постоянного … Словарь-справочник терминов нормативно-технической документации
АККУМУЛЯТОР — (вторичный элемент или накопительная батарея), гальванический элемент, или батарея, которую можно многократно подзаряжать. Широко известный автомобильный аккумулятор представляет собою свинцово кислотный элемент … Научно-технический энциклопедический словарь
Свинцовый аккумулятор — Автомобильный свинцово кислотный аккумулятор Аккумулятор электромобиля Свинцово кислотный аккумулятор наиболее распространенный на сегодняшний день тип аккумуляторов, изобретен в 1859 году французским физиком Гастоном Планте. Основные области… … Википедия
Автомобильный аккумулятор — 12В Автомобильный аккумулятор (для краткости может именоваться АКБ) тип электрического аккумулятора, применяемый на автомобильном или мототранспорте. Энергия аккумулятора используется в первую очере … Википедия
Железо-никелевый аккумулятор — Железо никелевый аккумулятор это вторичный химический источник тока, в котором железо анод, электролитом является водный раствор гидроксида натрия или калия (с добавками гидроксида лития), катод гидрат окиси никеля(III).… … Википедия
Источник