§42. Кислотные аккумуляторы
Принцип действия. Аккумулятором называется химический источник тока, который способен накапливать (аккумулировать) в себе электрическую энергию и по мере необходимости отдавать ее во внешнюю цепь. Накапливание в аккумуляторе электрической энергии происходит при пропускании по нему тока от

постороннего источника (рис. 158,а). Этот процесс, называемый зарядом аккумулятора, сопровождается превращением электрической энергии в химическую, в результате чего аккумулятор сам становится источником тока. При разряде аккумулятора (рис. 158, б) происходит обратное превращение химической энергии в электрическую. Аккумулятор обладает большим преимуществом по сравнению с гальваническим элементом. Если элемент разрядился, то он приходит в полную негодность; аккумулятор же. после разряда может быть вновь заряжен и будет служить источником электрической энергии. В зависимости от рода электролита аккумуляторы разделяют на кислотные и щелочные.
На локомотивах и электропоездах наибольшее распространение получили щелочные аккумуляторы, которые имеют значительно больший срок службы, чем кислотные. Кислотные аккумуляторы ТН-450 применяют только на тепловозах, они имеют емкость 450 А*ч, номинальное напряжение — 2,2 В. Аккумуляторная батарея 32 ТН-450 состоит из 32 последовательно соединенных аккумуляторов; буква Т означает, что батарея установлена на тепловозе, буква Н — тип положительных пластин (намазные).
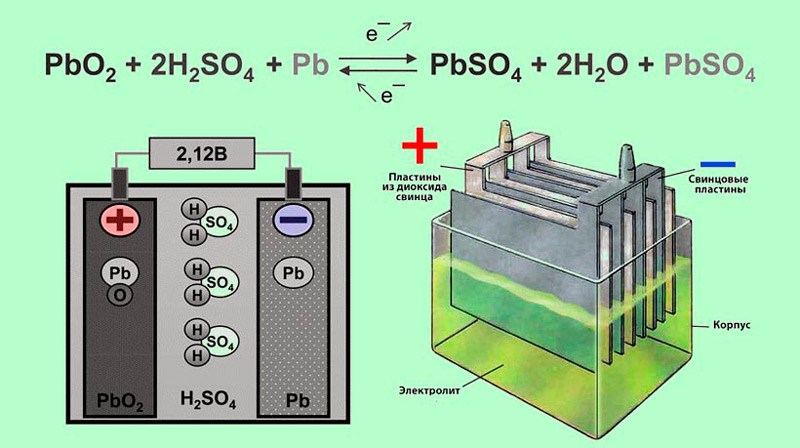
Устройство. В кислотном аккумуляторе электродами являются свинцовые пластины, покрытые так называемыми активными массами, которые взаимодействуют с электролитом при электрохимических реакциях в процессе заряда и разряда. Активной массой положительного электрода (анода) служит перекись свинца PbO2, а активной массой отрицательного электрода (катода) — чистый (губчатый) свинец Pb. Электролитом является 25—34 %-ный водный раствор серной кислоты.
Пластины аккумулятора могут иметь конструкцию поверхностного или намазного типа. Пластины поверхностного типа отливают из свинца; поверхность их, на которой происходят электрохимические реакции, увеличена благодаря наличию ребер, борозд и т. п. Их применяют в стационарных аккумуляторных батареях и некоторых батареях пассажирских вагонов.
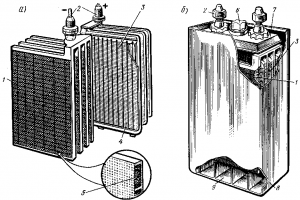
В аккумуляторных батареях тепловозов применяют пластины намазного типа (рис. 159, а). Такие пластины имеют остов из сплава свинца с сурьмой, в котором устроен ряд ячеек, заполняемых пастой.
Ячейки пластин после заполнения пастой закрывают свинцовыми листами с большим количеством отверстий. Эти листы предотвращают возможность выпадания из пластин активной массы и не препятствуют в то же время доступу к ней электролита.
Исходным материалом для изготовления пасты для положительных пластин служит порошок свинца Pb, а для отрицательных— порошок , перекиси свинца PbO2, которые замешиваются на водном растворе серной кислоты. Строение активных масс в таких пластинах пористое; благодаря этому в электрохимических реакциях участвуют не только поверхностные, но и глубоколежащие слои электродов аккумулятора.
Для повышения пористости и уменьшения усадки активной массы в пасту добавляют графит, сажу, кремний, стеклянный порошок, сернокислый барий и другие инертные материалы, называемые расширителями. Они не принимают участия в электрохимических реакциях, но затрудняют слипание (спекание) частиц свинца и его окислов и предотвращают этим уменьшение пористости.
Намазные пластины имеют большую поверхность соприкосновения с электролитом и хорошо им пропитываются, что способствует уменьшению массы и размеров аккумулятора и позволяет получать при разряде большие токи.
При изготовлении аккумуляторов пластины подвергают специальным зарядно-разрядным циклам. Этот процесс носит название формовки аккумулятора. В результате формовки паста положительных пластин электрохимическим путем превращается в перекись (двуокись) свинца PbO2 и приобретает коричневый цвет. Паста отрицательных пластин при формовке переходит в чистый свинец Pb, имеющий пористую структуру и называемый поэтому губчатым; отрицательные пластины приобретают серый цвет.
В некоторых аккумуляторах применены положительные пластины панцирного типа. В них каждая положительная пластина заключена в специальный панцирь (чехол) из эбонита или стеклоткани. Панцирь надежно удерживает активную массу пластины от осыпания при тряске и толчках; для сообщения же активной массы пластин с электролитом в панцире делают горизонтальные прорези шириной около 0725 мм.
Для предотвращения замыкания пластин посторонними предметами (щупом для измерения уровня электролита, устройством для заливки электролита и др.) пластины в некоторых аккумуляторах покрывают полихлорвиниловой сеткой.
Для увеличения емкости в каждый аккумулятор устанавливают несколько положительных и отрицательных пластин; одноименные пластины соединяют параллельно в общие блоки, к которым приваривают выводные штыри. Блоки положительных и отрицательных пластин обычно устанавливают в эбонитовом аккумуляторном сосуде (рис. 159,б) так, чтобы между каждыми двумя

пластинами одной полярности располагались пластины другой полярности. По краям аккумулятора ставят отрицательные пластины, так как положительные пластины при установке по краям склонны к короблению. Пластины отделяют одну от другой сепараторами, выполненными из микропористого эбонита, полихлорвинила, стекловойлока или другого изоляционного материала. Сепараторы предотвращают возможность короткого замыкания между пластинами при их короблении.
Пластины устанавливают в аккумуляторном сосуде так, чтобы между их нижней частью и дном сосуда имелось некоторое свободное пространство. В этом пространстве скапливается свинцовый осадок (шлам), образующийся вследствие отпадания отработавшей активной массы пластин в процессе эксплуатации.
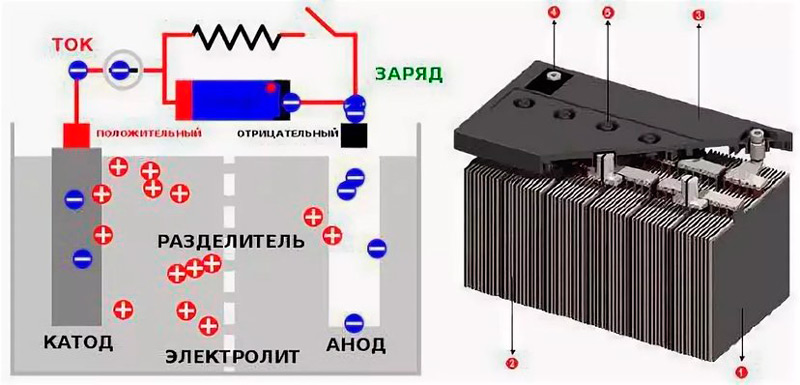
Разряд и заряд. При разряде аккумулятора (рис. 160, а) положительные ионы H2+ и отрицательные ионы кислотного остатка
S04-, на которые распадаются молекулы серной кислоты H2S04 электролита 3, направляются соответственно к положительному
1 и отрицательному 2 электродам и вступают в электрохимические реакции с их активными массами. Между электродами возникает
разность потенциалов около 2 В, обеспечивающая прохождение электрического тока при замыкании внешней цепи. В результате
электрохимических реакций, возникающих при взаимодействии ионов водорода с перекисью свинца PbO2 положительного
электрода и ионов сернокислого остатка S04— со свинцом Pb отрицательного электрода, образуется сернокислый свинец PbS04 (сульфат свинца), в который превращаются поверхностные слои активной массы обоих электродов. Одновременно при этих реакциях образуется некоторое количество воды, поэтому концентрация серной кислоты понижается, т. е. плотность электролита уменьшается.
Аккумулятор может разряжаться теоретически до полного превращения активных масс электродов в сернокислый свинец и истощения электролита. Однако практически разряд прекращают гораздо раньше. Образующийся при разряде сернокислый свинец представляет собой соль белого цвета, плохо растворяющуюся в электролите и обладающую низкой электропроводностью. Поэтому разряд ведут не до конца, а только до того момента, когда в сернокислый свинец перейдет около 35 % активной массы. В этом случае образовавшийся сернокислый свинец равномерно распределяется в виде мельчайших кристалликов в оставшейся активной массе, которая сохраняет еще достаточную электропроводность, чтобы обеспечить напряжение между электродами 1,7—1,8 В.
Разряженный аккумулятор подвергают заряду, т. е. присоединяют к источнику тока с напряжением, большим напряжения аккумулятора. При заряде (рис. 160,б) положительные ионы водорода перемещаются к отрицательному электроду 2, а отрицательные ионы сернокислого остатка S04— — положительному электроду 1 и вступают в химическое взаимодействие с сульфатом свинца PbS04, покрывающим оба электрода. В процессе возникающих электрохимических реакций сульфат свинца PbS04 растворяется и на электродах вновь образуются активные массы: перекись свинца PbO2 на положительном электроде и губчатый свинец Pb — на отрицательном. Концентрация серной кислоты при этом возрастает, т. е. плотность электролита увеличивается.
Электрохимические реакции при разряде и заряде аккумулятора могут быть выражены уравнением
Читая это уравнение слева направо, получаем процесс разряда, справа налево — процесс заряда.
Номинальный разрядный ток численно равен 0,1СНОМ, максимальный при запуске дизеля (стартерный режим) — примерно 3СНОМ, зарядный ток — 0,2 СНОМ, где СНОМ — номинальная емкость.
Полностью заряженный аккумулятор имеет э. д. с. около 2,2 В. Таково же приблизительно и напряжение на его зажимах, так как внутреннее сопротивление аккумулятора весьма мало. При разряде напряжение аккумулятора довольно быстро падает до 2 В, а затем медленно понижается до 1,8—1,7 В (рис. 161), при этом напряжении разряд прекращают во избежание повреждения аккумулятора. Если разряженный аккумулятор оставить на некоторое время в бездействии, то напряжение его снова восстанавливается до среднего значения 2 В. Это явление носит название «отдыха» аккумулятора. При нагрузке подобного «отдохнувшего» аккумулятора напряжение быстро понижается, поэтому измерение напряжения аккумулятора без нагрузки не дает правильного суждения о степени разряда.
При заряде напряжение аккумулятора быстро поднимается до 2,2 В, а затем медленно повышается до 2,3 В и, наконец, снова довольно быстро возрастает до 2,6—2,7 В. При 2,4 В начинают выделяться пузырьки газа, образующегося в результате разложения воды на водород и кислород. При 2,5 В оба электрода выделяют сильную струю газа, а при 2,6—2,7 В аккумулятор начинает как бы кипеть, что служит признаком окончания заряда. При отключении аккумулятора от источника зарядного тока напряжение его быстро снижается до 2,2 В.
Уход за аккумуляторами. Кислотные аккумуляторы быстро теряют емкость или даже приходят в полную негодность при

неправильной эксплуатации. В них происходит саморазряд, в результате которого они теряют свою емкость (примерно 0,5— 0,7 % в сутки). Для компенсации саморазряда неработающие аккумуляторные батареи необходимо периодически подзаряжать. При загрязнении электролита, а также крышек аккумуляторов, их выводов и междуэлементных соединений происходит повышенный саморазряд, быстро истощающий батарею.
Батарея аккумулятора должна быть всегда чистой, а выводы для предохранения от окисления покрыты тонким слоем технического вазелина. Периодически нужно проверять уровень электролита и степень заряженности аккумуляторов. Аккумуляторы должны периодически заряжаться. Хранение незаряженных аккумуляторов недопустимо. При неправильной эксплуатации аккумуляторов (разряде ниже 1,8—1,7 В, систематическом недозаряде, неправильном проведении заряда, длительном хранении незаряженного аккумулятора, понижении уровня электролита, чрезмерной плотности электролита) происходит повреждение их пластин, называемое сульфатацией. Это явление заключается в переходе мелкокристаллического сульфата свинца, покрывающего пластины при разряде, в нерастворимые крупнокристаллические химические соединения, которые при заряде не переходят в перекись свинца РbO2 и свинец РЬ. При этом аккумулятор становится непригодным для эксплуатации.
Источник
Устройство, принцип работы свинцово-кислотных АКБ
Любой автомобиль не может нормально работать без аккумулятора, и дело не только в возможности пуска двигателя – современные гибридные и полностью электрические модели машин используют АКБ в качестве основной движущей силой.
И хотя разработки новых, более ёмких типов аккумуляторов не прекращаются, старые добрые свинцово-кислотные модели всё ещё остаются в тренде, по-прежнему являясь самым распространённым типом автомобильных батарей. Почему аккумуляторы, первые прототипы которых появились ещё в XIX веке, не собираются уходить на пенсию? Давайте разбираться.
Устройство типового свинцово-кислотного аккумулятора
Использование химических реакций для выработки электроэнергии – идея старая. Электролиз как явление был известен со времён Фарадея, и именно он лежит в основе работы АКБ кислотно-свинцового типа. Если конкретнее, то такими реакциями является взаимодействие свинца и водного раствора серной кислоты, а также последней с диоксидом свинца при определённом направлении тока.
Устройство классического свинцово-кислотного аккумулятора нельзя назвать сложным: батарея пластин, заключенная в пластиковом корпусе, погружена в электролит. Когда к аккумулятору подключить нагрузку, то во время разряда на анодных пластинах свинец связывается с сульфатным остатком, образуя сульфат свинца, на катоде происходит реакция восстановления диоксида свинца. Во время зарядки всё меняется: на аноде сульфатированный свинец распадается на чистый металл, а остаток связывается с водой, восстанавливая объёмы серной кислоты в электролите. Эта схема, состоящая из несложных химических операций, выполняемых поочерёдно, позволяет батарее служить источником питания достаточно долго.
Но баланс сил меняется, если одна из операций, зарядка или разрядка, становится превалирующей. При перезаряде количество сульфата свинца уменьшается, что становится причиной старта процесса электролиза. В результате электролит закипает, и такое явление само по себе опасное, поскольку выделяемые при этом газы – взрывоопасны. С этим явлением борются, обеспечивая постепенное падение заряда на клеммах АКБ при увеличении напряжения. Но существует и другая опасность – выкипание электролита, поскольку оголенные пластины быстро начинают разрушаться под воздействием кислорода. При сильном разряде пластины сульфатируются, покрываясь слоем сульфата свинца, который не преобразуется в чистый свинец при зарядке, снижая ёмкость батареи.

Именно ёмкость является главной характеристикой аккумулятора, определяя, какое количество электроэнергии способна отдавать батарея в единицу времени. Поскольку ёмкость находится в прямой зависимости от площади свинцовых пластин, увеличение этого параметра возможно несколькими способами: использование большего количества пластин и увеличением их размера. Но поскольку и то, и другое имеют ограничения, то конструкция и состав свинцово-кислотных АКБ эволюционируют в других направлениях, где добиться существенного прогресса очень сложно. Например, разработчики много экспериментируют с составом пластин, внося в свинец различные добавки.
Принцип работы аккумулятора свинцово-кислотного типа
Востребованность АКБ этого типа обусловлена простотой и надёжностью конструкции. Обладая невысоким внутренним сопротивлением, такие батареи способны генерировать ток номиналом в сотни ампер, а для автомобильного стартера важным являются именно такие характеристики – мощь, выдаваемая на протяжении небольшого отрезка времени.
Нельзя сказать, что с конца 19 века конструкция, характеристики и КПД свинцово-кислотных аккумуляторов не совершенствовались, этот процесс продолжается и поныне.
Но в целом принцип функционирования остался неизменным. Современное устройство состоит из комплекта свинцовых электродов, заключённых в общий корпус. Пластины изготавливаются из пористой, губчатой разновидности свинца, что необходимо для обеспечения химических реакций с участием возможно большего числа молекул, катодные пластины покрыты слоем диоксида свинца. Когда электролитическая жидкость, состоящая из водного раствора серной кислоты, взаимодействует с пластинами при подсоединении к АКБ нагрузки, возникает электрический заряд. При этом свинец присоединяет к себе сульфатный остаток, образуя сульфат свинца и воду, количество серной кислоты в электролите уменьшается со скоростью, пропорциональной нагрузке. Другими словами, при прокручивании стартера ёмкость падает очень быстро, а если в качестве нагрузки выступает магнитола, разряд будет происходить намного медленнее.
При зарядке аккумулятора происходят обратные химические реакции – сульфат свинца разлагается, образуя серную кислоту и чистый свинец, плотность электролита возрастает, теоретически такие циклы могли бы продолжаться бесконечно, но на практике со временем способность пластин к самовосстановлению падает.
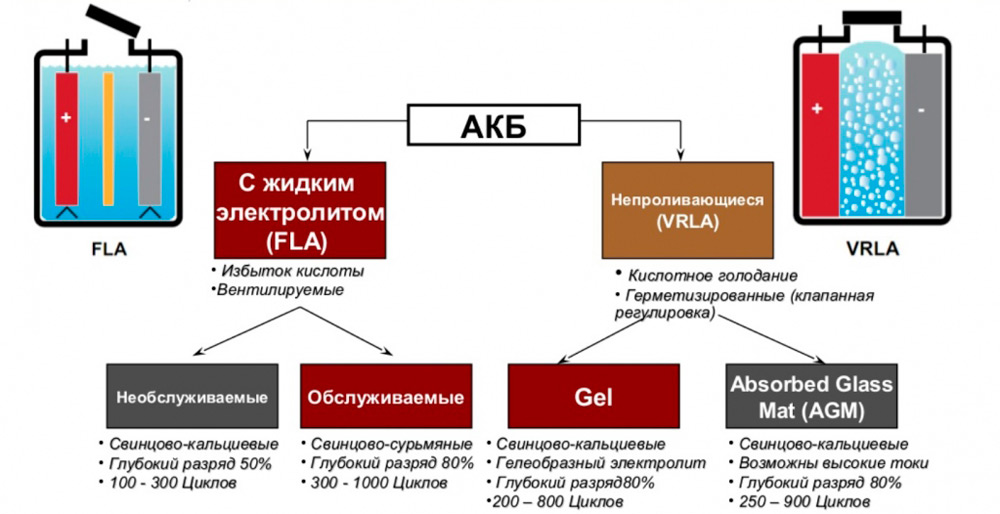
Классификация свинцово-кислотных АКБ
Как мы уже отмечали, бесконечно улучшать характеристики аккумуляторов невозможно. Изменяя и улучшая одни параметры, приходится мириться с тем, что при этом страдают другие характеристики. Но именно этот принцип послужил основой для создания батарей, обладающих разными свойствами.
Так, в настоящее время все АКБ этого типа подразделяются не негерметичные (обслуживаемые) и герметичные.
У первых благодаря наличию отверстий в пробках может происходить потеря электролита вследствие его испарения, поэтому такие батареи требуют периодической проверки уровня электролитической жидкости и её долива в случае необходимости. Кроме того, негерметичные батареи боятся резких наклонов и тем более переворотов.
Более современная герметичная разновидность лишена этих недостатков, а проблема накопления взрывоопасных газов здесь решается использованием специальной системы их сброса. Но такие аккумуляторы практически не подлежат ремонту и восстановлению, в отличие от обслуживаемых. Впрочем, средний их срок эксплуатации всё равно больше, так что проблема скорее надуманная, чем реальная.
По основным характеристикам свинцово-кислотные батареи подразделяются на следующие типы:
- стартерные. Как следует из названия, предназначены для пуска двигателей, их главной особенностью является способность выдавать большие токи на протяжении короткого периода времени (эта характеристика называется током саморазряда);
- буферные батареи. Используются в качестве аварийного источника питания, их нормальное состояние – постоянно находиться в режиме подзарядки;
- АКБ длительного электроснабжения способны выдавать токи больших номиналов длительное время. Это достаточно массивные и крупные изделия, используемые для аварийного питания в особо важных сферах (например, в реанимационных отделениях).
По конструкции пластин и типу электролита свинцово-кислотные АКБ бывают следующих типов:
- жидкостные, самая распространённая разновидность. Обеспечивают количество циклов заряда-разряда на уровне 260-500;
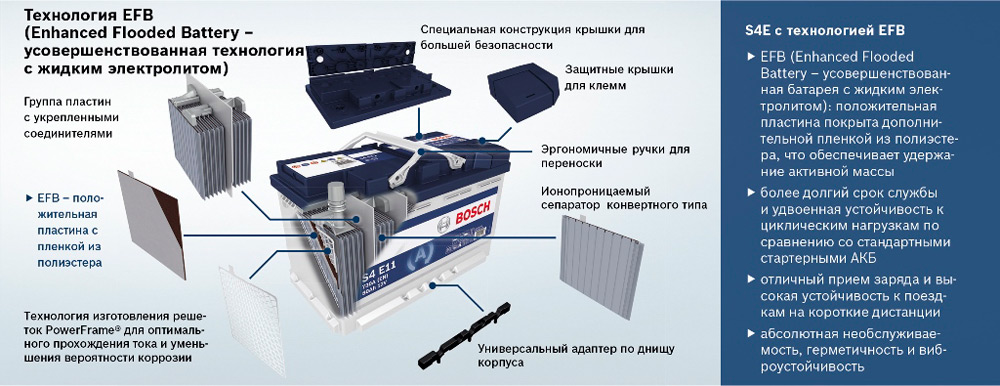
- батареи EFB обладают в целом лучшими характеристиками, в том числе и ресурсом (до 1000 циклов), но стоят достаточно дорого. Здесь электролит тоже жидкий, но его значительно меньше и пластины имеют другую конструкцию;
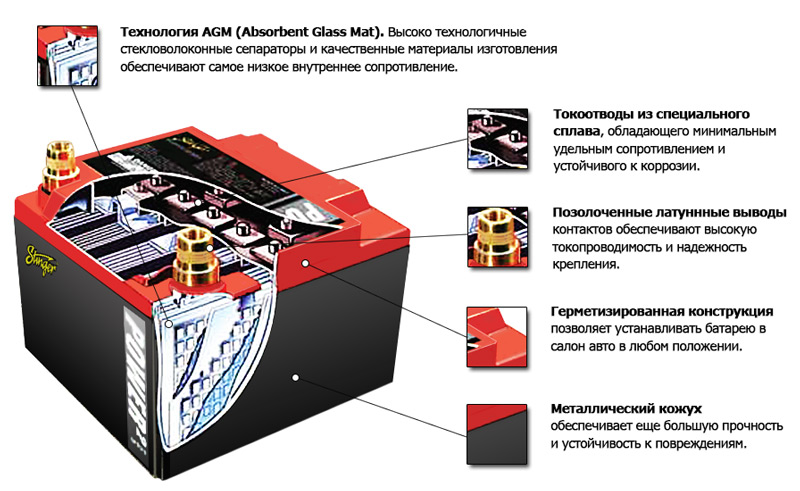
- AGM аккумуляторы известны тем, что электроды здесь облачены в стекловолоконные оболочки, препятствующие вытеканию электролита. Их достоинство – возможность быстрой зарядки и больший номинал вырабатываемого тока;
- гелевые аккумуляторы – полностью необслуживаемые, электролит здесь находится в гелеобразном виде, такие батареи можно устанавливать даже вертикально, они не боятся тряски и ударов.
Словом, совершенствование свинцово-кислотной технологии продолжается, пускай и эволюционным путём.
Достоинства и недостатки
Если говорить о плюсах и минусах аккумуляторный батарей свинцово-кислотного типа, то они хорошо известны.
Начнём, как обычно, с достоинств:
- благодаря простоте конструкции это самые дешёвые из всех разновидностей автомобильных АКБ;
- их легко утилизировать (в некоторых странах благодаря налаженной системе утилизации уровень повторного использования свинца при производстве аккумуляторов достигает 95-98%);
- по сравнению с батареями, в которых пластины изготовляются с применением других химических элементов, свинцово-кислотные отличаются способностью дольше удерживать заряд;
- необслуживаемые разновидности просты и неприхотливы в эксплуатации и не требует слежения за уровнем электролитической жидкости;
- у таких АКБ пусковой ток достаточно высокий, чтобы использовать их для пуска автомобильных моторов.
Но есть и трудноустранимые недостатки, над которыми исследователи бьются уже больше столетия:
- и свинец, и раствор серной кислоты – вещества, опасные с экологической точки зрения, поэтому такие аккумуляторы подлежат обязательной утилизации;
- при неконтролируемой зарядке возможен перегрев батареи, чреватый её взрывом;
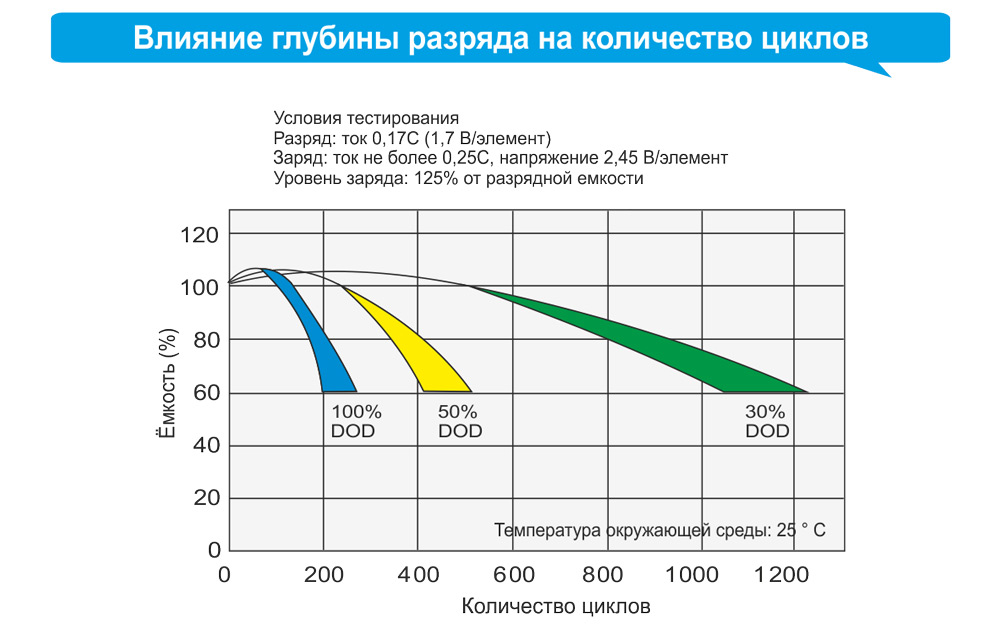
- жизненный цикл относительно небольшой, ограничен максимум 500-1000 циклами зарядки-разряда;
- нельзя допускать длительное хранение в разряженном состоянии – такая АКБ с большой вероятностью станет непригодной для использования;
- для кислотно-свинцовой батареи перезаряд столь же вреден, как и глубокая разрядка.
Если какие-то характеристики и удаётся улучшить, то за счёт ухудшения других, хотя положительные подвижки всё же происходят.
Сфера применения
Было бы неправильным считать, что свинцово-кислотные аккумуляторы используются исключительно в автомобильной отрасли. Да, по количественным показателям именно автомобильные батареи являются несомненными лидерами. Но они успешно применяются и в других сферах:
- при производстве осветительного оборудования;
- в качестве аварийных источников электроснабжения;
- в охранных системах, для обеспечения питанием сигнализаций;
- для приборов КИП;
- ими снабжаются бытовые и промышленные ИБП;
- такие батареи устанавливаются в детские автомобили, инвалидные коляски.
В заключение можно уверенно заявить, что АКБ этого типа не скоро уйдут «в тираж»: их востребованность обусловлена простотой конструкции, невысокой стоимостью, высокой ёмкостью, небольшой величине внутреннего сопротивления и, как следствие, невысокому уровню саморазряда.
Источник