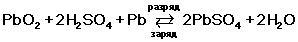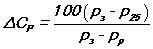- Химические процессы в свинцово-кислотных аккумуляторах
- Химическая реакция в аккумуляторе
- Процесс разрядки и зарядки АКБ
- На что влияет плотность электролита
- Улучшение свойств электролита
- Физико-химические процессы в аккумуляторных батареях
- Аккумулятор: устройство, назначение, принцип работы
- Устройство аккумулятора
- Принцип действия аккумуляторов
Химические процессы в свинцово-кислотных аккумуляторах
Как не формулируй название статьи, — оно всё равно будет правильным. Химия и энергия — связаны воедино в конструкции аккумулятора.
Свинцово-кислотные аккумуляторы могут работать несколько лет в режимах заряда-разряда. Они быстро подзаряжаются и быстро отдают запасённую энергию. Секрет этих метаморфоз кроется в химии, ведь именно она помогает преобразовывать электричество, но как?
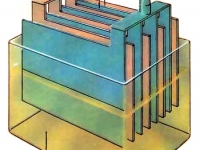
В качестве электролита используют жидкость, которая плохо проводит ток, но является хорошим проводником для ионов. Это водный раствор серной кислоты (H2S04). В химической реакции происходит процесс, всем известный со школьной скамьи — электролитическая диссоциация.
В процессе реакции, — положительно заряженные ионы (Н+) направляются к положительному электроду, а отрицательно заряженные ионы (SO42-) к отрицательному. Когда аккумулятор разряжается, то из восстановителя (губчатый свинец), через электролит к положительному электроду, — направляются ионы с положительным зарядом РЬ2+.
Четырехвалентные ионы свинца (РЬ4+) превращаются в двухвалентные (РЬ4+). Однако, это еще не все химические реакции. Когда ионы кислотных остатков с отрицательным зарядом (SO42-) соединяются с положительно заряженными ионами свинца (РЬ2+), то на обоих электродах образуется сульфат свинца (РЬSО4). А вот это уже плохо для аккумулятора. Сульфатация сокращает срок службы аккумулятора и постепенно накапливаясь, может привести к его разрушению. Побочным эффектом химических реакций в обычных свинцово-кислотных аккумуляторах, являются газы.
Что же происходят, когда аккумулятор подзаряжают?
Электроны направляются к электроду с отрицательным зарядом, где выполняют свою функцию — нейтрализуют ионы свинца (РЬ2+). Химические реакции, происходящие в аккумуляторных батареях можно описать такой формулой:
Плотность электролита, и его уровень в аккумуляторе, зависит от того, — заряжен, или разряжен аккумулятор. Изменения плотности электролита можно описать следующей формулой:
где показатель разрядки аккумулятора, который измеряется в процентах, — Cp. Плотность электролита при полной зарядке — Рз. Плотность электролита при полной разрядке — Pр.
Стандартная температура, при которой делают измерения + 25°С, Плотность электролита в соответствии с температурой + 25°С, г/см3 — Р25.
Во время химической реакции положительные электроды используют в 1,6 раза больше кислоты, чем отрицательные. Когда аккумулятор разряжается, то объем электролита растет, а когда заряжается, наоборот — уменьшается.
Таким вот образом, с помощью химических реакций, аккумулятор принимает, а потом отдаёт электрическую энергию.
Источник
Химическая реакция в аккумуляторе
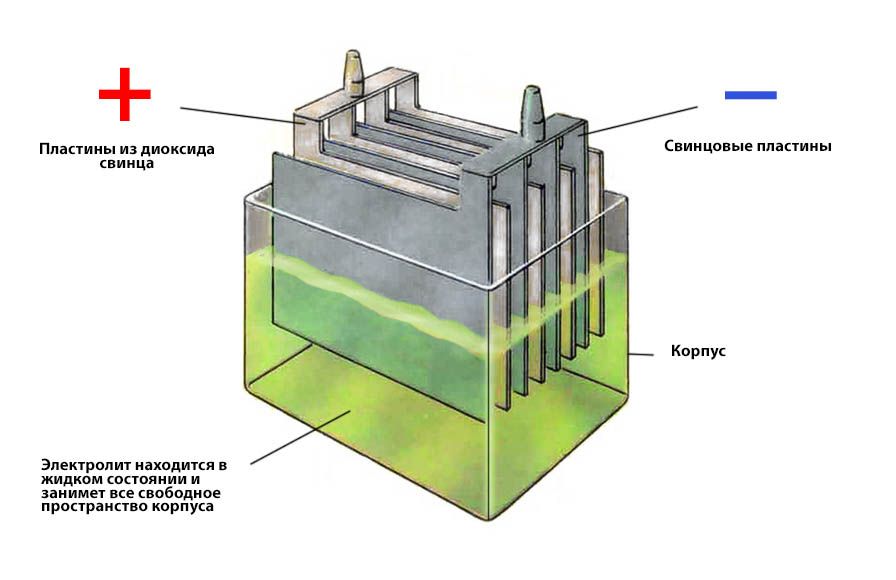
Ток в АКБ создает химическая реакция между электролитом и материалом электродов. В стандартных кислотно-свинцовых батареях отрицательный электрод сделан из пористого свинца, а положительный – из диоксида свинца. Электролит представляет собой раствор серной кислоты.
Процесс разрядки и зарядки АКБ
Когда аккумулятор разряжается, между свинцом, диоксидом свинца и серной кислотой происходит реакция: PbO2 + Pb + 2H2SO4 → 2PbSO4 + 2H2O. В результате этого процесса ионы перемещаются от одного электрода к другому, образуя электрический ток. В ходе этого процесса серная кислота присоединяется к активной массе пластин в виде сульфата свинца. В ответ на это концентрация воды в электролите повышается, а, следовательно, его плотность снижается. Когда раствор будет состоять только из воды, реакция остановится, а аккумулятор перестанет вырабатывать ток.
Чтобы аккумулятор снова получил заряд, на электроды нужно подать напряжение. Так ионы начнут движение в обратном направлении, из-за чего кристаллическая решетка сульфата свинца начнет разрушаться, а концентрация серной кислоты увеличиваться. Эта химическая реакция выглядит так: 2PbSO4 + 2H2O → PbO2 + Pb + 2H2SO4. Она происходит в процессе зарядки аккумулятора.
На что влияет плотность электролита
От состава электролита зависит емкость батареи. Чем выше изначальная концентрация серной кислоты, тем быстрее проходят все процессы в аккумуляторе, а концентрация сульфата на пластинах повышается. Происходит процесс сульфатации. Это явление негативно сказывается на работе батареи. При слишком высокой плотности также ускоряется коррозия пластин, в итоге, электрод разрушается и осыпается на дно батареи.
Улучшение свойств электролита
Производители постоянно повышают качества электролита. Создается замкнутая система вентиляции-конденсации, электролит помещается в волокнистый сепаратор или создается в форме геля. За счет этого удается не допустить расслоения электролита и испарения из него воды. Подобные технологии применяются в аккумуляторах бренда Mutlu. Они позволяют увеличить срок службы батареи и избавляют от необходимости регулярного обслуживания.
Источник
Физико-химические процессы в аккумуляторных батареях



Основные особенности конструкции.В элементах АБ активная масса отрицательного и положительного электродов состоит соответственно из металла и металлического соединения, которые механически закреплены на решетке или гребенке. Она выполнена обычно из того же металла, что отрицательный электрод. Между собой разнополярные электроды разобщены с помощью неметаллического (пластмассового, полимерного) сепаратора. Все аккумуляторные элементы расположены в пластмассовом корпусе и залиты раствором кислотного или щелочного электролита. Элементы имеют внешние разнополярные электрические выводы и соединяются между собой, как правило, по схеме последовательного включения. Корпус АБ обычно снабжен вентиляционным устройством для выхода испаряющихся (газообразных) продуктов реакции. Типичная конструкция АБ показана на рис. 1.3.
Известны также герметичные конструкции АЕ с малым количеством электролита, полностью адсорбированного в порах электродов. В этих АБ не требуются вентиляционные приспособления.
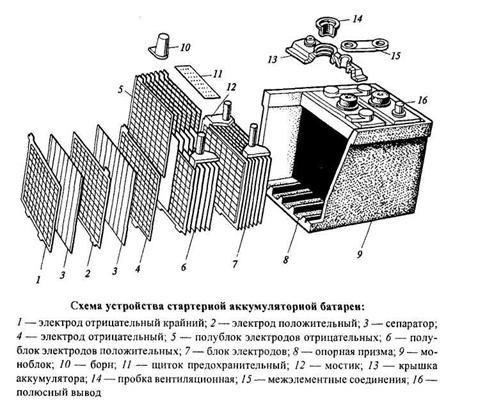
Рис. 1.3. Устройство свинцово-кислотной АБ: 1- сепаратор; 2 и 3 — блоки положительных и отрицательных пластин электродов; 4 — соединительная шина; 5 и 6 — положительный и отрицательный выводы; 7 —предохранительный щиток; 8 — собирательный мостик (баретка); 9 —опорный выступ; 10 — крышка секции; 11 — пробка заливного отверстия; 12 —моноблок (эбонитовый корпус с электролитом)
Электрохимические процессы.Принцип работы аккумуляторного элемента состоит в электрохимическом взаимодействии двух активных веществ (электродов), помещенных в электролит, при подключении внешнего электрического сопротивления (цепи нагрузки) к разнополярным электродам. Электролит участвует в токообразующей реакции и служит средой для перемещения положительных и отрицательных ионов, замыкающих цепь тока на внутреннем участке аккумулятора.
Электрохимические процессы обратимы. При разряде AБ на сопротивление нагрузки в аккумуляторных элементах происходит токообразующая электрохимическая реакция, которая сопровождается расходом (преобразованием) активных веществ электродов. Процесс заряда АБ при подключении ее к внешнему источнику электроэнергии сопровождается восстановлением химического состава активных веществ электродов в результате протекания электрического тока в направлении, обратном току разряда.
При разомкнутой внешней цепи обмен электрическими зарядами между электродами не происходит. Вблизи поверхности электродов (на границе раздела «твердый электрод — жидкий электролит») идут промежуточные реакции окисления и восстановления химических веществ с отдачей электронов и образованием ионов. Недостаток электронов на одном электроде приводит к появлению на нем положительного заряда, избыток электронов на другом электроде обусловливает его отрицательный заряд. Образуется разность электрических потенциалов, которая при разомкнутой цепи нагрузки равна ЭДС АБ.
Далее кратко рассмотрим работу основных типов кислотных и щелочных АБ, опуская промежуточные химические реакции.
Схема устройства свинцово-кислотного элемента АБ представлена на рис. 1.16. Положительный электрод изготовлен из двуокиси свинца PbO2, отрицательный электрод— из губчатого свинца РЬ. Электролитом служит водный раствор серной кислоты H2SO4. Стехиометрическое уравнение результирующей реакции в этой АБ имеет вид
причем при заряде эта реакция идет справа налево, а при разряде слева на право.
 |
В качестве примера щелочной АБ рассмотрим никель-кадмиевый элемент, схема устройства которого приведена на рис. 1.17. Положительный электрод в этой АБ выполнен из гидрооксида никеля (гидрата закиси никеля NiOOH), упакованного в ламелях из мелкоперфорированных стальных лент. Для повышения электропроводности активной массы электрода в нее добавляют особо чистый графит. Активная масса отрицательного электрода содержит губчатый кадмий Cd (в заряженном состоянии аккумулятора) или гидрооксид кадмия Cd(OH)2 (в разряженном состоянии). Для предотвращения слипания частиц Cd в плотную массу вводят в электрод небольшое количество добавки из оксида железа. В качестве щелочного электролита используют водный раствор гидроокиси калия КОН .

Стехиометрическое уравнение итоговой зарядно-разрядной реакции в никель-кадмиевой АБ имеет вид
причем вправо стрелка указывает направление реакции разряда, а влево — заряда.
Источник
Аккумулятор: устройство, назначение, принцип работы

Устройство аккумулятора
В автомобилях обычно применяют свинцово-кислотные аккумуляторы. Рассмотрим их устройство.
Все элементы располагаются в корпусе, который изготавливают из полипропилена. Корпус состоит из емкости, разделенной на шесть ячеек, и крышки, оснащенной дренажной системой для стравливания давления и отвода газа. На крышку выводится два полюса (клеммы) – положительный и отрицательный.
Содержимое каждой ячейки представляет собой пакет из 16 свинцовых пластин, полярность которых чередуется. Восемь положительных пластин, объединенных бареткой, являются плюсовым электродом (катодом), восемь отрицательных – минусовым (анодом). Каждый электрод выводится к соответствующей клемме аккумулятора.
Пакеты пластин в ячейках погружены в электролит – раствор серной кислоты и воды плотностью 1,28 г/см3.
Между пластинами электродов, для предотвращения замыкания, вставлены сепараторы – пористые пластины, которые не препятствуют циркуляции электролита и не взаимодействуют с ним.
Отдельная пластина электрода – это решетка из металлического свинца, в которую впрессован (намазан) реагент. Активная масса катода – диоксид свинца (PbO2), анода – губчатый свинец.
Принцип действия аккумуляторов

При разряде аккумулятора (подключении нагрузки) губчатый свинец анода выделяет положительные двухвалентные ионы свинца в электролит. Избыточные электроны перемещаются по внешней замкнутой электрической цепи к катоду, где происходит восстановление четырехвалентных ионов свинца до двухвалентных.
При их соединении с отрицательными ионами серного остатка электролита, образуется сульфат свинца на обоих электродах.
Ионы кислорода от диоксида свинца катода и ионы водорода из электролита соединяются, образуя молекулы воды. Поэтому плотность электролита понижается.
При заряде происходят обратные реакции. Под воздействием внешнего напряжения ионы двухвалентного свинца положительного электрода отдают по два электрона и окисляются в четырехвалентные. Эти электроны движутся к аноду и нейтрализуют ионы двухвалентного свинца, восстанавливая губчатый свинец. На катоде, путем промежуточных реакций, снова образуется двуокись свинца.
Химические реакции в одной ячейке вырабатывают напряжение 2 В, поэтому на клеммах аккумулятора из 6 ячеек и получается 12 В.
Из видео Вы сможете более подробно узнать, как работает аккумулятор:
Источник