§42. Кислотные аккумуляторы
Принцип действия. Аккумулятором называется химический источник тока, который способен накапливать (аккумулировать) в себе электрическую энергию и по мере необходимости отдавать ее во внешнюю цепь. Накапливание в аккумуляторе электрической энергии происходит при пропускании по нему тока от

постороннего источника (рис. 158,а). Этот процесс, называемый зарядом аккумулятора, сопровождается превращением электрической энергии в химическую, в результате чего аккумулятор сам становится источником тока. При разряде аккумулятора (рис. 158, б) происходит обратное превращение химической энергии в электрическую. Аккумулятор обладает большим преимуществом по сравнению с гальваническим элементом. Если элемент разрядился, то он приходит в полную негодность; аккумулятор же. после разряда может быть вновь заряжен и будет служить источником электрической энергии. В зависимости от рода электролита аккумуляторы разделяют на кислотные и щелочные.
На локомотивах и электропоездах наибольшее распространение получили щелочные аккумуляторы, которые имеют значительно больший срок службы, чем кислотные. Кислотные аккумуляторы ТН-450 применяют только на тепловозах, они имеют емкость 450 А*ч, номинальное напряжение — 2,2 В. Аккумуляторная батарея 32 ТН-450 состоит из 32 последовательно соединенных аккумуляторов; буква Т означает, что батарея установлена на тепловозе, буква Н — тип положительных пластин (намазные).
Устройство. В кислотном аккумуляторе электродами являются свинцовые пластины, покрытые так называемыми активными массами, которые взаимодействуют с электролитом при электрохимических реакциях в процессе заряда и разряда. Активной массой положительного электрода (анода) служит перекись свинца PbO2, а активной массой отрицательного электрода (катода) — чистый (губчатый) свинец Pb. Электролитом является 25—34 %-ный водный раствор серной кислоты.
Пластины аккумулятора могут иметь конструкцию поверхностного или намазного типа. Пластины поверхностного типа отливают из свинца; поверхность их, на которой происходят электрохимические реакции, увеличена благодаря наличию ребер, борозд и т. п. Их применяют в стационарных аккумуляторных батареях и некоторых батареях пассажирских вагонов.
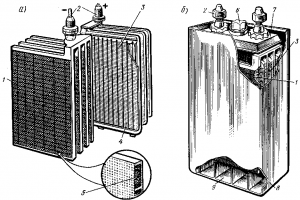
В аккумуляторных батареях тепловозов применяют пластины намазного типа (рис. 159, а). Такие пластины имеют остов из сплава свинца с сурьмой, в котором устроен ряд ячеек, заполняемых пастой.
Ячейки пластин после заполнения пастой закрывают свинцовыми листами с большим количеством отверстий. Эти листы предотвращают возможность выпадания из пластин активной массы и не препятствуют в то же время доступу к ней электролита.
Исходным материалом для изготовления пасты для положительных пластин служит порошок свинца Pb, а для отрицательных— порошок , перекиси свинца PbO2, которые замешиваются на водном растворе серной кислоты. Строение активных масс в таких пластинах пористое; благодаря этому в электрохимических реакциях участвуют не только поверхностные, но и глубоколежащие слои электродов аккумулятора.
Для повышения пористости и уменьшения усадки активной массы в пасту добавляют графит, сажу, кремний, стеклянный порошок, сернокислый барий и другие инертные материалы, называемые расширителями. Они не принимают участия в электрохимических реакциях, но затрудняют слипание (спекание) частиц свинца и его окислов и предотвращают этим уменьшение пористости.
Намазные пластины имеют большую поверхность соприкосновения с электролитом и хорошо им пропитываются, что способствует уменьшению массы и размеров аккумулятора и позволяет получать при разряде большие токи.
При изготовлении аккумуляторов пластины подвергают специальным зарядно-разрядным циклам. Этот процесс носит название формовки аккумулятора. В результате формовки паста положительных пластин электрохимическим путем превращается в перекись (двуокись) свинца PbO2 и приобретает коричневый цвет. Паста отрицательных пластин при формовке переходит в чистый свинец Pb, имеющий пористую структуру и называемый поэтому губчатым; отрицательные пластины приобретают серый цвет.
В некоторых аккумуляторах применены положительные пластины панцирного типа. В них каждая положительная пластина заключена в специальный панцирь (чехол) из эбонита или стеклоткани. Панцирь надежно удерживает активную массу пластины от осыпания при тряске и толчках; для сообщения же активной массы пластин с электролитом в панцире делают горизонтальные прорези шириной около 0725 мм.
Для предотвращения замыкания пластин посторонними предметами (щупом для измерения уровня электролита, устройством для заливки электролита и др.) пластины в некоторых аккумуляторах покрывают полихлорвиниловой сеткой.
Для увеличения емкости в каждый аккумулятор устанавливают несколько положительных и отрицательных пластин; одноименные пластины соединяют параллельно в общие блоки, к которым приваривают выводные штыри. Блоки положительных и отрицательных пластин обычно устанавливают в эбонитовом аккумуляторном сосуде (рис. 159,б) так, чтобы между каждыми двумя

пластинами одной полярности располагались пластины другой полярности. По краям аккумулятора ставят отрицательные пластины, так как положительные пластины при установке по краям склонны к короблению. Пластины отделяют одну от другой сепараторами, выполненными из микропористого эбонита, полихлорвинила, стекловойлока или другого изоляционного материала. Сепараторы предотвращают возможность короткого замыкания между пластинами при их короблении.
Пластины устанавливают в аккумуляторном сосуде так, чтобы между их нижней частью и дном сосуда имелось некоторое свободное пространство. В этом пространстве скапливается свинцовый осадок (шлам), образующийся вследствие отпадания отработавшей активной массы пластин в процессе эксплуатации.
Разряд и заряд. При разряде аккумулятора (рис. 160, а) положительные ионы H2+ и отрицательные ионы кислотного остатка
S04-, на которые распадаются молекулы серной кислоты H2S04 электролита 3, направляются соответственно к положительному
1 и отрицательному 2 электродам и вступают в электрохимические реакции с их активными массами. Между электродами возникает
разность потенциалов около 2 В, обеспечивающая прохождение электрического тока при замыкании внешней цепи. В результате
электрохимических реакций, возникающих при взаимодействии ионов водорода с перекисью свинца PbO2 положительного
электрода и ионов сернокислого остатка S04— со свинцом Pb отрицательного электрода, образуется сернокислый свинец PbS04 (сульфат свинца), в который превращаются поверхностные слои активной массы обоих электродов. Одновременно при этих реакциях образуется некоторое количество воды, поэтому концентрация серной кислоты понижается, т. е. плотность электролита уменьшается.
Аккумулятор может разряжаться теоретически до полного превращения активных масс электродов в сернокислый свинец и истощения электролита. Однако практически разряд прекращают гораздо раньше. Образующийся при разряде сернокислый свинец представляет собой соль белого цвета, плохо растворяющуюся в электролите и обладающую низкой электропроводностью. Поэтому разряд ведут не до конца, а только до того момента, когда в сернокислый свинец перейдет около 35 % активной массы. В этом случае образовавшийся сернокислый свинец равномерно распределяется в виде мельчайших кристалликов в оставшейся активной массе, которая сохраняет еще достаточную электропроводность, чтобы обеспечить напряжение между электродами 1,7—1,8 В.
Разряженный аккумулятор подвергают заряду, т. е. присоединяют к источнику тока с напряжением, большим напряжения аккумулятора. При заряде (рис. 160,б) положительные ионы водорода перемещаются к отрицательному электроду 2, а отрицательные ионы сернокислого остатка S04— — положительному электроду 1 и вступают в химическое взаимодействие с сульфатом свинца PbS04, покрывающим оба электрода. В процессе возникающих электрохимических реакций сульфат свинца PbS04 растворяется и на электродах вновь образуются активные массы: перекись свинца PbO2 на положительном электроде и губчатый свинец Pb — на отрицательном. Концентрация серной кислоты при этом возрастает, т. е. плотность электролита увеличивается.
Электрохимические реакции при разряде и заряде аккумулятора могут быть выражены уравнением
Читая это уравнение слева направо, получаем процесс разряда, справа налево — процесс заряда.
Номинальный разрядный ток численно равен 0,1СНОМ, максимальный при запуске дизеля (стартерный режим) — примерно 3СНОМ, зарядный ток — 0,2 СНОМ, где СНОМ — номинальная емкость.
Полностью заряженный аккумулятор имеет э. д. с. около 2,2 В. Таково же приблизительно и напряжение на его зажимах, так как внутреннее сопротивление аккумулятора весьма мало. При разряде напряжение аккумулятора довольно быстро падает до 2 В, а затем медленно понижается до 1,8—1,7 В (рис. 161), при этом напряжении разряд прекращают во избежание повреждения аккумулятора. Если разряженный аккумулятор оставить на некоторое время в бездействии, то напряжение его снова восстанавливается до среднего значения 2 В. Это явление носит название «отдыха» аккумулятора. При нагрузке подобного «отдохнувшего» аккумулятора напряжение быстро понижается, поэтому измерение напряжения аккумулятора без нагрузки не дает правильного суждения о степени разряда.
При заряде напряжение аккумулятора быстро поднимается до 2,2 В, а затем медленно повышается до 2,3 В и, наконец, снова довольно быстро возрастает до 2,6—2,7 В. При 2,4 В начинают выделяться пузырьки газа, образующегося в результате разложения воды на водород и кислород. При 2,5 В оба электрода выделяют сильную струю газа, а при 2,6—2,7 В аккумулятор начинает как бы кипеть, что служит признаком окончания заряда. При отключении аккумулятора от источника зарядного тока напряжение его быстро снижается до 2,2 В.
Уход за аккумуляторами. Кислотные аккумуляторы быстро теряют емкость или даже приходят в полную негодность при

неправильной эксплуатации. В них происходит саморазряд, в результате которого они теряют свою емкость (примерно 0,5— 0,7 % в сутки). Для компенсации саморазряда неработающие аккумуляторные батареи необходимо периодически подзаряжать. При загрязнении электролита, а также крышек аккумуляторов, их выводов и междуэлементных соединений происходит повышенный саморазряд, быстро истощающий батарею.
Батарея аккумулятора должна быть всегда чистой, а выводы для предохранения от окисления покрыты тонким слоем технического вазелина. Периодически нужно проверять уровень электролита и степень заряженности аккумуляторов. Аккумуляторы должны периодически заряжаться. Хранение незаряженных аккумуляторов недопустимо. При неправильной эксплуатации аккумуляторов (разряде ниже 1,8—1,7 В, систематическом недозаряде, неправильном проведении заряда, длительном хранении незаряженного аккумулятора, понижении уровня электролита, чрезмерной плотности электролита) происходит повреждение их пластин, называемое сульфатацией. Это явление заключается в переходе мелкокристаллического сульфата свинца, покрывающего пластины при разряде, в нерастворимые крупнокристаллические химические соединения, которые при заряде не переходят в перекись свинца РbO2 и свинец РЬ. При этом аккумулятор становится непригодным для эксплуатации.
Источник
Химические источники тока



Химические источники тока (ХИТ) – электрохимические устройства, в результате работы которых химическая энергия окислительно-восстановительных процессов превращается в электрическую энергию постоянного тока. К ним относятся гальванические элементы, аккумуляторы, топливные элементы.
Основными характеристиками ХИТ являются ЭДС, напряжение, мощность, энергия, которую они отдают во внешнюю цепь, саморазряд.
Химические источники тока должны иметь: как можно большее значение ЭДС; максимально высокие удельные мощность и емкость; по возможности меньшую разность между напряжением источника тока и его ЭДС; максимально низкий саморазряд (потеря емкости ХИТ при разомкнутой цепи).
Гальванические элементы – устройства, в которых энергия химической окислительно-восстановительной реакции превращается в электрическую. Он состоят из двух электродов, имеющих различный электродный потенциал, электролита, который дает возможность перемещаться ионам от одного электрода к другому, и металлического проводника для перемещения электронов, направленный поток которых приводит к возникновению электрического тока.
Рассмотрим механизм возникновения электрического тока на примере медно-цинкового гальванического элемента (элемента Даниэля – Якоби). Он состоит из двух электродов – цинкового и медного, погруженных в соответствующие растворы сульфатов цинка и меди, которые разделены полупроницаемой перегородкой 1 (внутренняя цепь) (рис. 8.3.). Электроды соединены друг с другом металлическим проводником (внешняя цепь) через гальванометр 2.
Если цепь замкнута, то происходят процессы гидратации ионов металлов на обоих электродах и устанавливается химическое равновесие между металлом и его ионами в растворе:
Zn « Zn 2+ + 2 
Cu « Cu 2+ + 2 
Металлы приобретают разный по величине заряд, так как Zn и Cu имеют различную активность, которая может быть оценена с помощью стандартных электродных потенциалов ( 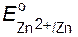
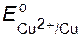
Рис. 8.3. Схема гальванического элемента Даниэля-Якоби
Таким образом, концентрация свободных электронов на этих электродах различна. При замыкании внешней цепи происходит выравнивание этих концентраций и электроны по внешнему проводнику перемещаются от Zn электрода к Cu электроду. Концентрация электронов на цинковом электроде уменьшается, что приводит к смещению равновесия на границе Zn/ZnSO4 в сторону образования катионов Zn 2+ ,т.е. происходит процесс растворения цинка (Zn 

Процесс окисления в электрохимии называется анодным процессом, а сам электрод – анодом.
Концентрация свободных электронов на медном электроде увеличивается в результате поступивших электронов с цинка и равновесие на границе Cu/CuSO4 смещается в сторону образования металлической меди (Cu 

Процесс восстановления в электрохимии называется катодным процессом, а сам электрод – катодом.
На Zn – аноде происходит процесс окисления, в результате которого цинк переходит в раствор в виде катионов, на Cu – катоде – процесс восстановления ионов меди:
(−) А: Zn « Zn 2+ + 2 
(+) К: Cu 2+ + 2 
Cu 2+ + Zn « Zn 2+ + Cu.
Таким образом, при работе гальванического элемента одновременно происходят процессы окисления и восстановления.
Схематически работа гальванического элемента записывается следующим образом:

(−) Zn /Zn 2+ ç H2SO4 ç Cu 2+ /Cu (+).

В гальваническом элементе происходит движение ионов (SO4 2- ) во внутренней цепи и электронов (2 
В скобках указываются знаки электродов, причем анод записывается слева, катод – справа. Стрелки указывают направление движения электронов во внешней цепи и ионов SO4 2- во внутренней.
Важной характеристикой гальванического элемента является его движущая сила (ЭДС), которая представляет собой разность потенциалов электродов при отсутствии тока во внешней цепи:

Потенциалы каждого электрода зависят от концентрации потенциалопределяющих ионов и вычисляются по уравнению Нернста (8.4).
Если условия стандартные ([ZnSO4] и [CuSO4 ] = 1 моль/л, температура Т = 298 К), то для медно–цинкового элемента стандартная ЭДС о равна:
ЭДС о = +0,34 – (–0,76) = 1,1 В.
Среди большого разнообразия гальванических элементов можно выделить три основных типа:
1. Два различных металла находятся в растворах своих солей.
К этому типу относится рассмотренный гальванический элемент Даниэля–Якоби.
2. Два различных металла находятся в одном электролите.
Примером такого элемента может служить элемент Вольта, состоящий из двух пластин (Zn и Cu), находящихся в растворе серной кислоты.
При его работе происходят следующие процессы:
(–) А: Zn « Zn 2+ + 2 
(+) К: 2Н + + 2 
Выделяющийся водород насыщает поверхность катода (меди), в результате чего получается электрод другого состава (не медный, а водородный). Схема гальванического элемента Вольта:

(−) Zn/Zn 2+ çH2SO4ç2H + /H2 
3. Два одинаковых электрода находятся в растворах своих солей с различной концентрацией ионов металла в электролите. Такой элемент называется концентрационным.
Схема медного концентрационного гальванического элемента:

(−) Cu/CuSO4 ççCuSO4/Cu (+).
Роль анода выполняет электрод, находящийся в более разбавленном растворе, так как его электродный потенциал имеет более низкое значение по сравнению со вторым электродом. ЭДС такого гальванического элемента зависит только от соотношения концентраций потенциалопределяющих ионов (в данном случае от концентрации CuSO4).
Как источники электрической энергии концентрационные гальванические элементы практического значения не имеют.
Электродвижущая сила и напряжение гальванического элемента. ЭДС – разность потенциалов между катодом и анодом в условиях обратимой работы ГЭ. Измерение ЭДС обычно проводят компенсационным методом при отсутствии тока в цепи.
Прямым измерением разности потенциалов на клеммах элемента с помощью обычного вольтметра можно получить значение напряжения U, которое не равно ЭДС элемента.
Напряжение – разность между электродами работающего гальванического элемента (в необратимых условиях работы). Напряжение элемента U 2+ |H2SO4|Pb 2+ /PbO2 (+).
При взаимодействии оксида свинца с H2SO4 образуется PbSO4
При первичном и последующих зарядах аккумулятора, когда он работает как электрохимическая ячейка, PbSO4 на катоде превращается в свинец Pb, а на аноде – в диоксид свинца PbO2, которые и являются электродами.
При работе аккумулятора – его разряде, когда он работает как химический источник тока, на электродах протекают электродные процессы в обратном направлении.
(−) К: PbSO4(тв) + 2 

(+) А: PbSO4(тв) + 2Н2О ↔ PbО 2(тв) + 2 

Электродные реакции в свинцовом аккумуляторе можно представить в виде:
Pb(тв) + SO 

PbО2(тв) + 2 



По мере его разряда расходуются материалы катода (PbО2) , анода (Pb) и электролит – серная кислота. Напряжение на зажимах аккумулятора падает, и его необходимо заряжать. Свинцовый аккумулятор не должен разряжаться до полного расходования активности веществ. Если это произойдет, то станет невозможной его перезарядка (аккумулятор можно разряжать до 1,8 В). Для заряда аккумулятор подключают к внешнему источнику тока, направление тока противоположно разрядному.
Во время заряда аккумулятора растет напряжение на его полюсах. В конце оно достигает такого значения, что начинается электролиз воды, сопровождающийся выделением водорода на катоде и кислорода – на аноде:



(+) А: 2Н2О « О2 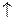

2Н2О « 2Н2 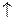
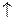
Так называемое «кипение» электролита является признаком окончания заряда свинцового аккумулятора.
Стандартные величины потенциалов для электродов свинцового аккумулятора имеют следующие значения: Е о 

ЭДС аккумулятора как химического источника тока рассчитывается по уравнению:
ЭДС аккумулятора зависит от концентрации (активности) серной кислоты, которая возрастает при заряде аккумулятора и уменьшается при его разряде. О степени разряда аккумулятора судят по концентрации электролита, т.е. концентрации H2SO4. На практике с помощью ареометра обычно измеряется не концентрация кислоты, а ее плотность.
При плотности 

ЭДС заряженного аккумулятора приблизительно равна 2 В. Если последовательно соединить 6 элементов, то получится обычный автомобильный аккумулятор с ЭДС=12 В.
Заряженный аккумулятор может быть сразу использован по назначению. При хранении же из него выливают электролит и промывают водой. В таком виде он может находиться до 2−х лет, и для его использования достаточно лишь залить электролит. При хранении незаряженного аккумулятора с раствором серной кислоты происходит его «сульфатирование» – образование на пластинках большого количества PbSO4.
Когда кислотный аккумулятор работает, давая ток, PbSO4 осаждается в очень мелкозернистой форме на поверхности электродов. Когда же аккумулятор выключен, мелкозернистый слой рекристаллизуется и образуются более крупные кристаллы, которые могут закупорить поры электрода, уменьшая его поверхность, или отрываться от электрода и основной причиной выхода аккумулятора из строя, поэтому нужно следить, чтобы аккумулятор не простаивал частично в разряженном состоянии.
Преимущества свинцового аккумулятора – высокий КПД (около 80 %), высокая ЭДС и относительно малое ее изменение при разряде, большая электрическая емкость, устойчивость в работе.
Недостатки – большая масса и, следовательно, малая удельная емкость, саморазряд аккумулятора при хранении, малый срок службы (2-5 лет), а также токсичность свинца и сильные окислительные свойства H2SO4. Совершенствование свинцовых аккумуляторов идет по пути изыскания новых сплавов свинца для решеток, препятствующих образованию и выпадению шлама, кристаллизации сульфата свинца, облегченных и прочных материалов корпусов и улучшения качества сепараторов.
Щелочные аккумуляторы различаются по материалу пластин отрицательно заряженного электрода. Наиболее распространенные из них кадмий – никелевые (Cd − Ni) и железо – никелевые (Fe – Ni) аккумуляторы. Активная масса положительных пластин состоит в основном из гидратированного оксида никеля (III). Кроме того, в ней содержится графит, добавляемый для увеличения электропроводности. Электролитом служит раствор КОН (20 %), содержащий небольшое количество LiOH. ЭДС заряженного аккумулятора (Cd − Ni) приблизительно равна 1,3 В.
Окислительно-восстановительные процессы, протекающие при работе щелочного аккумулятора (Сd – Ni), могут быть представлены следующими уравнениями:
(−) A: Cd + 2OH — 





Cхемы щелочных аккумуляторов:
(−) Cd/ KOH, LiOH /NiO(OH), C (+);
(−) Fe/ KOH, LiOH /NiO(OH), C (+).
В отличие от свинцового аккумулятора срок службы щелочных аккумуляторов порядка 10 лет. Они хорошо выдерживают перегрузку и длительное время пребывания в разряженном состоянии. Однако меньшая ЭДС и более высокая стоимость не позволяют во многих случаях заменить ими свинцовые аккумуляторы. Щелочные аккумуляторы выпускаются промышленностью различной удельной емкости (0,5–120 А 
Топливные элементы (ТЭ) – перспективные химические источники тока (электрохимические генераторы), способные непрерывно работать за счет постоянного подвода к электродам новых порций реагентов и отвода продуктов реакции.
Топливными элементами называются устройства, в которых химическая энергия окисления топлива превращается в электрическую энергию.
ТЭ относятся к первичным химическим источникам тока с непрерывной подачей реагентов (окислителя и восстановителя) и непрерывным удалением продуктов сгорания.
Сгорание топлива (окисление) практически во всех ТЭ происходит на поверхности инертных электродов (Сграфит, Pt, Ag, Ni и др.), содержащих катализаторы.
В качестве топлива (восстановителя) используют жидкие или газообразные водород, гидразин, гидриды металлов, оксид углерода, различные углеводороды, метиловый спирт и др. спирты. Твердое топливо – уголь, кокс, торф обладает малой реакционной способностью и может быть окислено при температуре выше 1000 о С. Электролитами являются водные растворы кислот или щелочей, расплавленные карбонаты или гидриды металлов. Как правило, природные виды топлива подвергаются предварительной обработке для получения электрохимически активных веществ.
На практике наиболее часто применяется водородно-кислородный топливный элемент со щелочным электролитом (30−40 % раствор KOH). Устройство элемента чрезвычайно простое. В герметически закрытом сосуде установлено два пористых, металлических (чаще всего никелевых) электрода, разделенных слоем раствора гидроксида калия (натрия). В ТЭ подаются газообразный водород и кислород.
Схема водородно-кислородного ТЭ имеет следующий вид:
где Ме – проводник первого рода, играющий роль катализатора электродного процесса и токоотвода (например, специально обработанные Ni, Co, металлы группы Pt).
Элемент работает при 50-70 о С, при атмосферном давлении. На электродах протекают следующие реакции:
на аноде – окисление водорода
(−) А: H2 + 2OH — « 2H2O + 2 
на катоде – восстановление кислорода
(+) К: ½O2 + H2O + 2 

Во внешней цепи происходит движение электронов от анода к катоду, а в растворе – движение ионов OH — от катода к аноду.
Уравнение токообразующей реакции имеет вид:
Н2 + ½O2 
Таким образом, в водородно-кислородном ТЭ протекает процесс сгорания водорода с образованием воды. В результате протекания этой реакции в цепи генерируется постоянный ток и химическая энергия превращается в электрическую энергию постоянного тока.
Источник





