- Почему стоит переплатить за литиевый аккумулятор
- 1. Разница в весе
- 2. Плотность энергии
- 3. Срок службы и ТО
- 4. Эффективность (КПД)
- 5. Ток заряда и время полной зарядки
- 6. Влияние высоких температур
- Заключение
- Плотность энергии
- Почему аккумуляторы не резиновые?
- Простые способы исчерпаны
- Технологическая революция
- Национальная безопасность
- Литий-ионный аккумулятор — Lithium-ion battery
- СОДЕРЖАНИЕ
- Терминология
- Батарея против ячейки
- История
- Задний план
- Разработка
- Коммерциализация и достижения
- Рынок
- Картель фиксирования цен
Почему стоит переплатить за литиевый аккумулятор
Перед теми, кто задумался о сборке электровелосипеда своими руками, довольно часто встаёт вопрос выбора типа аккумулятора. И первое, что приходит в голову — использовать свинцово-кислотный аккумулятор. Причины такого выбора на первый взгляд очевидны — низкая стоимость и простота конструкции (не требуется плата управления BMS).
Однако есть весомые аргументы, которые могут побудить вас отказаться от использования свинцового аккумулятора в пользу литий-ионного. Давайте разберём их по порядку.
1. Разница в весе
Не секрет, что свинцовые аккумуляторы весят больше литий-ионных, но часто этому не придают значения, ставя в приоритет преимущество в цене. Тем не менее, для электровелосипеда низкий вес может оказаться важнее цены, так как его вы будете поднимать и спускать по лестнице (возможно даже каждый день), а иногда загружать в автомобиль для транспортировки.
Кроме того, дополнительный вес не лучшим образом сказывается на динамике разгона и торможения. Больше вес — выше инерционность — значительнее износ тормозных колодок. Также применение тяжёлых свинцовых аккумуляторов увеличивает нагрузку на раму и систему подвески велосипеда.
Рассмотрим, к примеру, аккумулятор на 36 В ёмкостью 7-7,5 Ач. Свинцово-кислотное исполнение представляет собой три последовательно соединённых аккумулятора по 12 В 7Ач, а литий-ионный вариант — 30 ячеек типоразмера 18650 по 2500 мАч и плата BMS, весом около 100 грамм.
2,5 Ач 3,6 В 0,05 кг
3S1P (3 элемента)
10S3P (30 элементов)
Вес готовой батареи
Из таблицы видно, что вес свинцового аккумулятора превосходит вес литий-ионного более чем в 4 раза, и эта разница будет влиять на эксплуатационные характеристики велосипеда, в том числе на запас хода на одном заряде.
Стоит также учесть, что в случае, если вы забыли зарядить батарею перед поездкой, возвращаться на педалях со свинцом на борту будет гораздо тяжелее.
2. Плотность энергии
Литий-ионные аккумуляторы по плотности энергии превосходят свинцовые в несколько раз. В нашем случае свинцово-кислотный аккумулятор имеет абсолютную ёмкость 252 Втч (7 Ач * 36 В) при весе 6,9 кг. То есть плотность энергии составляет 36,5 Втч/кг.
В то же время, литий-ионный аккумулятор при абсолютной ёмкости 270 Втч (7,5 Ач * 36 В) весит 1,6 кг, то есть его плотность энергии составляет 168 Втч/кг, что превосходит значение свинцового аккумулятора более чем в 4 раза.
3. Срок службы и ТО
При эксплуатации аккумулятора его ёмкость постепенно снижается, и скорость этого снижения зависит сразу от нескольких факторов, среди которых глубина разряда, температура эксплуатации и другие.
Срок службы аккумулятора, при соблюдении правил его хранения и эксплуатации, определяется количеством циклов заряда-разряда. Для свинцово-кислотных батарей эта характеристика находится в диапазоне от 200 до 1000 циклов, у литий-ионных аккумуляторов — в диапазоне от 1000 до 4000 циклов.
Кроме этого, свинцовые батареи имеют более высоких саморазряд, и требуют периодического обслуживания — подзарядки и корректировки плотности электролита. Литий-ионные батареи практически не требуют обслуживания, так как функцию балансировки, то есть выравнивания напряжений на ячейках, выполняет плата управления батареей (BMS, Battery Management System).
4. Эффективность (КПД)
Коэффициент полезного действия свинцовых аккумуляторов при правильной эксплуатации составляет около 80-90%. Другими словами, если на зарядку батареи потрачено 100 Вт энергии, то на разряде она отдаст только 80-90 Вт.
У литий-ионных батарей этот параметр достигает 95-97%, то есть практически вся энергия, затраченная при заряде, будет возвращена при подключении нагрузки.
5. Ток заряда и время полной зарядки
Оптимальным током заряда для свинцовых аккумуляторов считается ток, равный 10% от ёмкости аккумулятора в ампер-часах (0,1С), то есть в рассмотренном выше случае при ёмкости 7 Ач оптимальный зарядный ток составит 0,7 А. При быстрой зарядке допускается ток 0,2С (в нашем случае 1,4 А). В обоих случаях ближе к концу процесса зарядки этот ток должен быть уменьшен.
Для литий-ионных аккумуляторов ток заряда лежит в пределах от 0,2С до 1С (при быстрой зарядке), то есть при ёмкости аккумулятора 7 Ач он составит от 1,4 А до 7 А. Заряд осуществляется сначала постоянным током, а затем, при достижении верхнего напряжения, ток постепенно снижается.
В большинстве случаев на полную зарядку свинцового аккумулятора требуется 8-16 часов времени, на зарядку литий-ионного — всего 2-4 часа. Это преимущество по времени позволяет существенно подзарядить литий-ионную батарею даже во время остановки в кафе на обед, если вы отправились в дальнее путешествие.
6. Влияние высоких температур
При эксплуатации в условиях высоких температур происходит быстрая деградация аккумулятора. Но что подразумевается под понятием высокой температуры и откуда она берётся?
При подключении к аккумулятору нагрузки, например, в виде электродвигателя велосипеда, через него начинает протекать ток. Каждый аккумулятор имеет своё внутреннее сопротивление. Соответственно, протекание тока приводит к постепенному нагреву аккумулятора — конечно, в зависимости от силы тока. Чем мощнее нагрузка (выше ток), тем быстрее происходит нагрев.
Если нагрузка слишком высокая для данного аккумулятора, он довольно быстро нагревается, и начинается процесс его ускоренной деградации. Результатом этого процесса является существенное снижение ёмкости аккумулятора, и как следствие, необходимость его последующей замены.
Для свинцового аккумулятора деградация начинается при превышении температуры 25 градусов, для литий-ионного — при превышении 45 градусов по Цельсию.
Заключение
Давайте подведём итог всему вышесказанному. Если вы уже приняли решение использовать свинцово-кислотный аккумулятор на электровелосипеде, используйте. Но если всё-таки аргументы, приведённые в данной статье, вас переубедили, и склонили к приобретению литий-ионного аккумулятора, вы определённо останетесь довольны его значительно меньшим весом, компактными габаритами, отсутствием потребности в обслуживании, более длительным сроком службы и скоростью зарядки.
Кстати, если сравнить разницу в денежном выражении, получим следующее. Три свинцовых аккумулятора обойдутся в сумму около 5 тысяч рублей. Сборка батареи заключается только в последовательном соединении этих аккумуляторов.
Литий-ионную батарею на 7,5 Ач 36 В лучше приобретать в собранном виде, и она обойдётся вам в сумму около 10 тысяч рублей (из Китая дешевле, но дольше, при сомнительном качестве и без гарантии). Это в 2 раза дороже свинцово-кислотного исполнения, но она обладает довольно существенными преимуществами.
Кроме того, литий-ионные аккумуляторы можно приобрести сразу с корпусом, предназначенным для установки на раму велосипеда, и с зарядным устройством в комплекте. Это позволит сократить время сборки, обеспечит надёжную работу батареи и безопасность при эксплуатации.
Если статья Вам понравилась, или даже оказалась полезной, подписывайтесь на наш канал в Яндекс.Дзен. Впереди будет ещё больше интересного!
Источник
Плотность энергии
Почему аккумуляторы не резиновые?
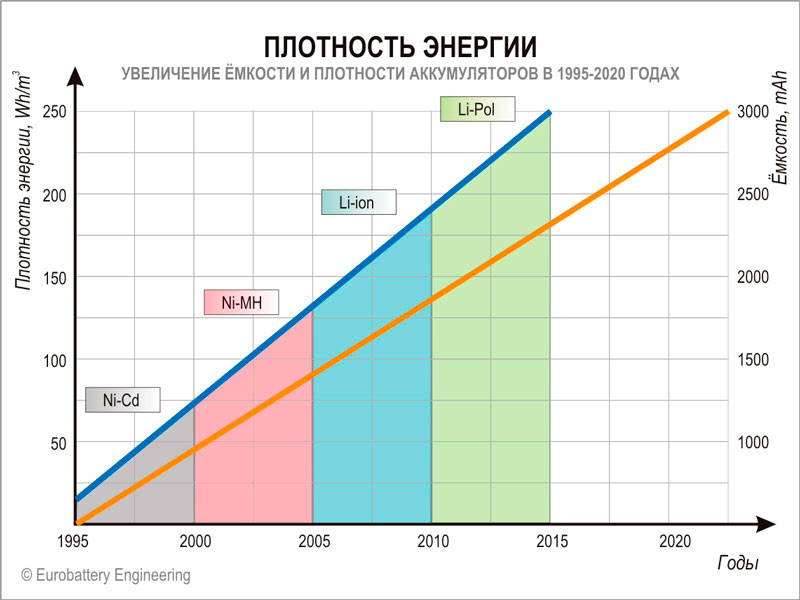
Количество (плотность) энергии аккумулятора зависит от типа электрохимической схемы и является определяющим фактором технологического прогресса.
Благодаря аккумуляторам мобильные устройства отвязались от розетки, но далеко отползти пока не удаётся. Аккумулятора хватает на 1 день автономной работы смартфона, несколько часов ноутбука и полчаса квадрокоптера. Электромобиль может проехать до 400 километров, но его аккумулятор весит половину этого автомобиля и стоит тоже половину. Причина одна: плотность энергии современных аккумуляторов слишком маленькая.
Количество энергии (Wh), которое может запасти аккумулятор в удельном весе (кг) или удельном объеме (m 3 ) в первую очередь зависит от типа электрохимической схемы аккумулятора. На заре мобильной эры использовались никель-кадмиевые (Ni-Cd) и никель-металлогидридные (Ni-MH) аккумуляторы. Плотность энергии была низкой (50-100 Wh/kg), а мобильные устройства громоздкими и тяжелыми. Переход на литиевые аккумуляторы позволил значительно увеличить плотность энергии. Сейчас наибольшей плотностью энергии обладают литий-полимерные аккумуляторы (250 Wh/kg).
Простые способы исчерпаны
Также невозможно бесконечно увеличивать площадь электродов путем уменьшения их толщины. Алюминиевая и медная фольга толщиной 50-100 мкм может быть заменена на более тонкую, но это грозит повреждением при изготовлении и коррозией при эксплуатации. Таким образом, простые способы повышения плотности энергии практически исчерпаны.
Технологическая революция
Национальная безопасность
Еще одним важным фактором сдерживающим развитие аккумуляторов являются национальные интересы нефтепроизводящих стран: в первую очередь США и России. В настоящий момент развитие электромобилей является дотационным и поддерживается правительствами только из экологических соображений. Электромобили не представляют экономической угрозы для двигателей внутреннего сгорания, так как электроэнергия первоначально вырабатывается из нефтепродуктов на тепловых электростанциях. Изобретение мощных аккумуляторов даст зеленый свет развитию зеленых технологий, которые без должного аккумулирования энергии пока малоэффективны: солнце светит днем, ветер дует когда хочет, а не когда надо потребителям. Если же себестоимость выработки и хранения зеленой энергии станет дешевле черной, то развитие электромобилей и электросамолетов начнется естественным (бездотационным) путем, а энергетическим монополиям придется потесниться.
Часто задаваемые вопросы:
Что такое плотность энергии?
- Количество энергии на единицу объёма.
- Для батареи плотность энергии — это количество энергии (Wh), которое может запасти аккумулятор в удельном весе или удельном объеме.
Увеличится ли плотность энергии аккумулятора, если добавлять катодный материал?
- Увеличив количество ионов лития, увеличивается количество заряда, а значит должна возрасти плотность энергии аккумулятора. В теории должно быть именно так.
- Только на практике ионы с меньшей эффективностью вылетают с катода.
- В итоге, увеличивается саморазряд, уменьшается ресурс и безопасность.
Аккумуляторы повышенной ёмкости — это миф или реальность?
- Да, реальность, но в разумных пределах.
- Нет, это маркетинговая уловка.
Источник
Литий-ионный аккумулятор — Lithium-ion battery
 | |
| Удельная энергия | 100–265 Вт · ч / кг (0,36–0,875 МДж / кг) |
|---|---|
| Плотность энергии | 250–693 Вт · ч / л (0,90–2,43 МДж / л) |
| Удельная мощность | 340 Вт / кг |
| Эффективность заряда / разряда | 80–90% |
| Энергия / потребительская цена | 6,4 Втч / долл. США |
| Скорость саморазряда | От 0,35% до 2,5% в месяц в зависимости от уровня заряда |
| Долговечность цикла | 400–1200 циклов |
| Номинальное напряжение ячейки | 3,6 / 3,7 / 3,8 / 3,85 В , LiFePO4 3,2 В |
Литий-ионная аккумуляторная батарея или литий-ионная батарея представляет собой тип аккумуляторной батареи . Литий-ионные батареи обычно используются в портативной электронике и электромобилях, и их популярность растет в военной и аэрокосмической сферах. Прототип литий-ионной батареи был разработан Акирой Йошино в 1985 году на основе более ранних исследований Джона Гуденафа , М. Стэнли Уиттингема , Рашида Язами и Коичи Мидзусима в 1970–1980-х годах, а затем коммерческий литий-ионный аккумулятор был разработан компанией Команда Sony и Asahi Kasei во главе с Ёсио Ниши в 1991 году.
В батареях ионы лития перемещаются от отрицательного электрода через электролит к положительному электроду во время разряда и обратно при зарядке. Литий-ионные батареи используют интеркалированное соединение лития в качестве материала положительного электрода и обычно графит на отрицательном электроде. Батареи обладают высокой плотностью энергии , без эффекта памяти (кроме ячеек LFP ) и низким саморазрядом . Однако они могут представлять угрозу безопасности, поскольку содержат горючие электролиты, и в случае повреждения или неправильной зарядки могут привести к взрывам и пожарам. Samsung была вынуждена отозвать телефоны Galaxy Note 7 после возгорания литий-ионных аккумуляторов, и было несколько инцидентов, связанных с батареями на Boeing 787 .
Химический состав, производительность, стоимость и характеристики безопасности зависят от типа литий-ионных батарей. В портативной электронике в основном используются литий-полимерные батареи (с полимерным гелем в качестве электролита), оксид лития-кобальта ( LiCoO
2 ) катодный материал и графитовый анод, которые вместе обладают высокой плотностью энергии. Литий-фосфат железа ( LiFePO
4 ), оксид лития-марганца ( LiMn
2 О
4 шпинель, или ли
2 MnO
3 слоистых материалов на основе лития (LMR-NMC)) и оксида лития, никеля, марганца, кобальта ( LiNiMnCoO
2 или NMC) может иметь более длительный срок службы и более высокую скорость передачи данных. Такие батареи широко используются для электрических инструментов, медицинского оборудования и других ролей. NMC и его производные широко используются в электромобилях.
Области исследований литий-ионных аккумуляторов, среди прочего, включают продление срока службы, увеличение плотности энергии, повышение безопасности, снижение стоимости и увеличение скорости зарядки. В настоящее время ведутся исследования в области негорючих электролитов как пути к повышению безопасности, основанной на воспламеняемости и летучести органических растворителей, используемых в типичном электролите. Стратегии включают водные литий-ионные батареи , керамические твердые электролиты, полимерные электролиты, ионные жидкости и сильно фторированные системы.
СОДЕРЖАНИЕ
Терминология
Батарея против ячейки
Клетка является основным электрохимическое устройство , которое содержит электроды, сепаратор и электролит.
Аккумулятор или аккумуляторная батарея представляет собой набор клеток или клеточных агрегатов, с корпусом, электрических соединений, и , возможно , электронику для управления и защиты.
История
Задний план
Литиевые батареи были предложены британским химиком М. Стэнли Уиттингемом , ныне работающим в Бингемтонском университете . Уиттингем начал исследования, которые привели к его прорыву в Стэнфордском университете . В начале 1970-х он открыл, как хранить ионы лития в слоях дисульфидного материала. После того, как его наняла компания Exxon, он усовершенствовал это нововведение. Уиттингем использовал сульфид титана (IV) и металлический литий в качестве электродов. Однако эту перезаряжаемую литиевую батарею невозможно было реализовать на практике. Дисульфид титана был неудачным выбором, поскольку его нужно было синтезировать в полностью закрытых условиях, а также он был довольно дорогим (
1000 долларов за килограмм для сырья из дисульфида титана в 1970-х годах). При контакте с воздухом дисульфид титана реагирует с образованием соединений сероводорода, которые имеют неприятный запах и токсичны для большинства животных. По этой и другим причинам Exxon прекратил разработку литий-титановой дисульфидной батареи Уиттингема. Батареи с металлическими литиевыми электродами представляют собой проблемы с безопасностью, поскольку металлический литий реагирует с водой с выделением легковоспламеняющегося газообразного водорода. Следовательно, исследования перешли к разработке батарей, в которых вместо металлического лития присутствуют только соединения лития , способные принимать и выделять ионы лития.
Обратимое внедрение в графит и внедрение в катодные оксиды было обнаружено в 1974–76 гг. Й.О. Безенхардом из Мюнхенского технического университета . Безенхард предложил его применение в литиевых элементах. Разложение электролита и соинтеркаляция растворителя в графит были серьезными ранними недостатками для срока службы батарей.
Разработка
- 1973 — Адам Хеллер предложил литий-тионилхлоридную батарею, которая до сих пор используется в имплантированных медицинских устройствах и в системах защиты, где требуется срок хранения более 20 лет, высокая плотность энергии и / или устойчивость к экстремальным рабочим температурам.
- 1977 — Самар Басу продемонстрировал электрохимическое внедрение лития в графит в Пенсильванском университете . Это привело к разработке работоспособного электрода с интеркалированным литием графита в Bell Labs ( LiC
6 ), чтобы предоставить альтернативу батарее с литиево-металлическим электродом. - 1979 — Работая в отдельных группах, Нед А. Годшалл и др., А вскоре после этого Джон Б. Гуденаф ( Оксфордский университет ) и Коичи Мидзусима ( Токийский университет ) продемонстрировали перезаряжаемый литиевый элемент с напряжением в диапазоне 4 В с использованием лития. диоксид кобальта ( LiCoO
2 ) в качестве положительного электрода и металлического лития в качестве отрицательного электрода. Это нововведение предоставило материал положительного электрода, который позволил использовать первые коммерческие литиевые батареи. LiCoO
2 представляет собой стабильный материал положительного электрода, который действует как донор ионов лития, что означает, что его можно использовать с материалом отрицательного электрода, отличным от металлического лития. Благодаря использованию стабильных и простых в обращении материалов отрицательных электродов LiCoO
2 позволили использовать новые аккумуляторные системы. Годшалл и др. далее идентифицировали аналогичную ценность тройных соединений оксидов лития-переходных металлов, таких как шпинель LiMn 2 O 4 , Li 2 MnO 3 , LiMnO 2 , LiFeO 2 , LiFe 5 O 8 и LiFe 5 O 4 (и позже литий-медь -оксидные и литий-никелевые катодные материалы в 1985 г.) - 1980 — Рашид Язами продемонстрировал обратимое электрохимическое внедрение лития в графит и изобрел литиево-графитовый электрод (анод). Органические электролиты, доступные в то время, разложились бы во время зарядки графитовым отрицательным электродом. Язами использовал твердый электролит, чтобы продемонстрировать, что литий может быть обратимо интеркалирован в графит посредством электрохимического механизма. По состоянию на 2011 год графитовый электрод Язами был наиболее часто используемым электродом в коммерческих литий-ионных батареях.
- Отрицательный электрод берет свое начало в PAS (полиацетатный полупроводниковый материал), обнаруженном Токио Ямабе, а затем Шидзукуни Ята в начале 1980-х годов. Зародышем этой технологии стало открытие проводящих полимеров профессором Хидеки Сиракава и его группой, и ее также можно рассматривать как начавшуюся с литий-ионной полиацетиленовой батареи, разработанной Аланом МакДиармидом и Аланом Дж. Хигером и др.
- 1982 — Годшалл и др. были награждены патентом США 4340652 на использование LiCoO 2 в качестве катодов в литиевых батареях на основании докторской диссертации Годшалла из Стэнфордского университета. диссертации и публикации 1979 года.
- 1983 — Майкл М. Теккерей , Питер Брюс , Уильям Дэвид и Джон Б. Гуденаф разработали марганцевуюшпинель , Mn 2 O 4 , в качестве заряженного катодного материала для литий-ионных батарей. Он имеет два плоских плато при разряде с литием, одно при 4 В, стехиометрии LiMn 2 O 4 , и одно при 3 В с конечной стехиометрией Li 2 Mn 2 O 4 .
- 1985 — Акира Йошино собрал прототип элемента, используя углеродистый материал, в который ионы лития можно было вставить в качестве одного электрода, и оксид лития-кобальта ( LiCoO).
2 ) как другой. Это значительно повысило безопасность. LiCoO
2 позволил производить промышленное производство и выпускать коммерческую литий-ионную батарею. - 1989 — Арумугам Мантирам и Джон Б. Гуденаф открыли класс полианионных катодов. Они показали, что положительные электроды, содержащие полианионы , например сульфаты , производят более высокие напряжения, чем оксиды, из-за индуктивного эффекта полианиона. Этот класс полианионов содержит такие материалы, как фосфат лития-железа .
Коммерциализация и достижения
Производительность и емкость литий-ионных батарей увеличивались по мере развития.
- 1991 — Sony и Asahi Kasei выпустили первый коммерческий литий-ионный аккумулятор. Японскую команду, которая успешно коммерциализировала технологию, возглавил Ёсио Ниши.
- 1996 — Гуденаф, Акшая Падхи и его коллеги предложили фосфат лития-железа ( LiFePO
4 ) И другие фосфо- оливинов (литиевые фосфаты металлов с той же структурой , как минеральный оливин ) в качестве положительного электрода материалов. - 1998 — К. С. Джонсон, Дж. Т. Воги, М. М. Теккерей, Т. Э. Бофингер и С. А. Хакни сообщают об открытии катодных материалов NMC с высоким содержанием лития высокой емкости .
- 2001 — Арумугам Мантирам и его сотрудники обнаружили, что ограничения емкости слоистых оксидных катодов являются результатом химической нестабильности, которую можно понять, исходя из относительного положения металлической 3d-полосы относительно верхней части кислородной 2p-полосы. Это открытие имело важные последствия для практически доступного композиционного пространства слоистых оксидных катодов литий-ионных аккумуляторов, а также их стабильности с точки зрения безопасности.
- 2001 — Кристофер Джонсон, Майкл Теккерей, Халил Амин и Джекук Ким подают патент на литий-никель-марганцево-кобальт-оксидные катоды (NMC), богатые литием, на основе доменной структуры.
- 2001 — Чжунхуа Лу и Джефф Дан подали патент на класс материалов положительных электродов NMC, который обеспечивает повышение безопасности и плотности энергии по сравнению с широко используемым оксидом лития-кобальта.
- 2002 — Йет-Мин Чан и его группа в Массачусетском технологическом институте продемонстрировали существенное улучшение характеристик литиевых батарей за счет повышения проводимости материала за счет легирования его алюминием , ниобием и цирконием . Точный механизм, вызывающий повышение, стал предметом широких споров.
- 2004 — Йет-Мин Чианг снова повысил производительность за счет использования частиц фосфата лития-железа диаметром менее 100 нанометров. Это уменьшило плотность частиц почти в сто раз, увеличило площадь поверхности положительного электрода и улучшило емкость и характеристики. Коммерциализация привела к быстрому росту рынка литий-ионных аккумуляторов большей емкости, а также к битве за нарушение патентных прав между Чангом и Джоном Гуденаф .
- 2005 — Я. Сонг, П. Я. Завалий и М. Стэнли Уиттингем сообщают о новом двухэлектронном катодном материале из фосфата ванадия с высокой плотностью энергии.
- 2011 — Катоды из литий-никель-марганцево-кобальтового оксида (NMC), разработанные в Аргоннской национальной лаборатории , коммерчески производятся компанией BASF в Огайо.
- 2011 г. — литий-ионные батареи составили 66% всех продаж портативных вторичных (то есть перезаряжаемых) батарей в Японии.
- 2012 — Джон Гуденаф, Рашид Язами и Акира Йошино получили медаль IEEE 2012 года за экологические технологии и технологии безопасности за разработку литий-ионной батареи.
- 2014 — Джон Goodenough, Yoshio Нись, Рашид Язы и Акир Yoshino были удостоены Чарльз Старк Draper премия в Национальной академии наук за их усилия первопроходцев в этой области.
- 2014 — Коммерческие батареи от Amprius Corp. достигли уровня 650 Вт · ч / л (увеличение на 20%) с использованием кремниевого анода и были доставлены клиентам.
- 2016 — Коичи Мидзусима и Акира Ёсино получили награду NIMS от Национального института материаловедения за открытие Мидзусимой катодного материала LiCoO 2 для литий-ионной батареи и разработку Йошино литий-ионной батареи.
- 2016 — З. Ци и Гэри Кениг сообщили о масштабируемом методе производства LiCoO размером менее микрометра.
2 используя шаблонный подход. - 2019 г. — Нобелевская премия по химии была присуждена Джону Гуденафу, Стэнли Уиттингему и Акире Йошино «за разработку ионно-литиевых батарей».
В 2010 году мировая производственная мощность литий-ионных аккумуляторов составила 20 гигаватт-часов. К 2016 году он составлял 28 ГВтч, из них 16,4 ГВтч в Китае. Производство сложное и требует много шагов.
Рынок
В 2012 году промышленность произвела около 660 миллионов цилиндрических литий-ионных элементов; 18650 размера на сегодняшний день является наиболее популярным для цилиндрических клеток. Если бы Tesla выполнила свою задачу по поставке 40000 электромобилей Model S в 2014 году и если бы батарея емкостью 85 кВтч, в которой используется 7104 таких элемента, оказалась бы такой же популярной за рубежом, как и в Соединенных Штатах, исследование 2014 года показало, что одна только Model S будет использовать почти 40 процентов предполагаемого мирового производства цилиндрических батарей в течение 2014 года. С 2013 года производство постепенно переходило на более емкие элементы емкостью 3000+ мАч. Ожидается, что годовой спрос на плоские полимерные элементы в 2013 году превысит 700 миллионов.
В 2015 году смета расходов варьировалась от 300 до 500 долларов США / кВтч. В 2016 году GM сообщила, что будет платить 145 долларов США за кВтч за батареи в Chevy Bolt EV. Ожидается, что в 2017 году средняя стоимость установки систем накопления энергии в жилых домах упадет с 1600 долларов за кВтч в 2015 году до 250 долларов за киловатт-час к 2040 году, а к 2030 году цена снизится на 70%. В 2019 году стоимость некоторых аккумуляторных батарей для электромобилей оценивались в 150–200 долларов, и компания VW отметила, что платит 100 долларов за кВтч за свое следующее поколение электромобилей .
Батареи используются для хранения энергии в сети и вспомогательных услуг . Для литий-ионного накопителя в сочетании с фотоэлектрической системой и биогазовой электростанцией с анаэробным сбраживанием литий-ионный аккумулятор будет приносить более высокую прибыль, если он будет циклически повторяться чаще (следовательно, более высокая выработка электроэнергии за весь срок службы), хотя срок службы сокращается из-за деградации.
Литий-никель-марганец-кобальтоксидные (NMC) элементы бывают нескольких коммерческих типов, в зависимости от соотношения составляющих металлов. NMC 111 (или NMC 333) состоит из равных частей никеля, марганца и кобальта, тогда как NMC 532 состоит из 5 частей никеля, 3 частей марганца и 2 частей кобальта. По состоянию на 2019 год NMC 532 и NMC 622 были предпочтительными типами с низким содержанием кобальта для электромобилей, при этом NMC 811 и даже более низкие соотношения кобальта увеличивались, что уменьшало зависимость от кобальта. Тем не менее, потребление кобальта для электромобилей увеличилось на 81% с первой половины 2018 года до 7200 тонн в первой половине 2019 года при емкости батареи 46,3 ГВтч.
Картель фиксирования цен
Было обнаружено, что нарушающий антимонопольное законодательство картель ценового фиксирования между 9 корпоративными семьями, включая LG Chem , GS Yuasa , Hitachi Maxell , NEC , Panasonic / Sanyo , Samsung , Sony и Toshiba, фальсифицировал цены на батареи и ограничивал выпуск продукции в период с 2000 по 2011 год.
Источник