- Аккумуляторные батареи. Виды и устройство. Применение
- Виды и типы АКБ
- Мы не будем приводить все типы, а лишь дадим небольшую таблицу с описанием наиболее распространенных:
- Устройство
- Особенности разных типов АКБ
- —>Автозапчасти и СТО —>
- Батареи первого поколения — батареи с жидким электролитом
- Батареи второго поколения — герметизированные гелевые батареи (Gelled Electrolite)
- Батареи третьего поколения — герметизированные батареи с абсорбированным сепараторами электролитом AGM (Absorptive Glass Mat)
- Что такое аккумулятор?
- Батареи первого поколения — батареи с жидким электролитом
- Батареи второго поколения — герметизированные гелевые батареи (Gelled Electrolite)
- Батареи третьего поколения — герметизированные батареи с абсорбированным сепараторами электролитом AGM (Absorptive Glass Mat)
Аккумуляторные батареи. Виды и устройство. Применение
АКБ или аккумуляторные батареи – это оборудование, которое состоит из нескольких аккумуляторов. Оно может накапливать, хранить и расходовать энергию. Благодаря обратимости химических процессов, происходящих внутри аккумулятора, такие устройства могут заряжаться и разряжаться многократно.
Сфера применения аккумуляторов весьма обширна. Они применяются в автомобилях и различной бытовой технике, например, в пультах ДУ и ноутбуках. Но также и в качестве резервных источников питания в медицинской сфере, производстве, космической отрасли, дата-центрах.
Виды и типы АКБ
Сегодня производят около 30 типов аккумуляторов. Такое большое количество обуславливается возможностью применять в качестве электродов и электролитов различные химические элементы. Именно от материала электрода и состава электролита зависят все характеристики аккумулятора.
Мы не будем приводить все типы, а лишь дадим небольшую таблицу с описанием наиболее распространенных:
Устройство
1 — Отрицательный электрод
2 — Разделительный слой
3 — Положительные электроды
4 — Отрицательный контакт
5 — Предохранительный клапан
6 — Положительные электроды
7 — Положительный контакт
Аккумуляторные батареи состоят из нескольких банок аккумуляторов, соединенных либо параллельно, либо последовательно. Последовательное соединение применяют в целях увеличения напряжения, а параллельное для увеличения силы тока.
Каждый из отдельно взятого аккумулятора в АКБ состоит из двух электродов и электролита, помещенных в корпус из специального материала.
Электрод с отрицательным зарядом – анод, с положительным зарядом – катод. Анод содержит восстановитель, катод – окислитель. Внутри корпуса аккумулятора стоит разделительная пластина, которая не позволяет электродам замыкаться.
Электролит – водный раствор, в который погружены оба электрода.
При разрядке аккумулятора восстановитель анода начинает окисляться и выделяются электроны. Электроны затем попадают в электролит и оттуда движутся к катоду, при этом создавая разрядный ток. Попадая в катод электроны восстанавливают его окислитель. Простыми словами можно описать процесс так: электроны идут от отрицательного электрода к положительному и создают разрядный ток.
При зарядке аккумулятора электроды меняются своим химическим составом и происходит обратная реакция. Электроны здесь двигаются от положительного анода к отрицательному катоду.
Особенности разных типов АКБ
Свинцово-кислотные аккумуляторы
Разработан Гастоном Планте в 19 веке. Эти аккумуляторные батареи сегодня наиболее актуальны благодаря дешевизне и универсальности. Сфера их применения обширна ввиду большого количества разновидностей этого типа. В качестве отрицательно заряженных электродов здесь используется оксид свинца. Положительные электроды выполняются из свинца. Электролит – серная кислота.
У свинцовых-кислотных батарей есть следующие разновидности:
- LA – аккумуляторы с напряжением 6 или 12 Вольт. Традиционное устройство для осуществления запуска двигателей автомобилей. Требуют постоянного обслуживания и вентиляции.
- VRLA – напряжением 2, 4, 6 или 12 Вольт. Клапанно-регулируемая свинцово-кислотная аккумуляторная батарея. Как видно из названия этот АКБ укомплектован разгрузочным клапаном. Его роль – минимизировать выделение газа и расход воды. Такие батареи можно устанавливать в жилых помещениях.
- AGM VRLA – как и предыдущий тип оснащен клапаном, но имеет совсем другие свойства. В аккумуляторах, сделанных по технологии AGM роль сепаратора играет стекловолокно. Его микропоры пропитаны жидким электролитом. Такие АКБ не требуют обслуживания и устойчивы к вибрациям.
- GEL VRLA – подвид свинцово-кислотных аккумуляторов с гелеобразным электролитом. Благодаря этому увеличен их ресурс заряда/разряда. Не требуют обслуживания.
- OPzV – герметичные аккумуляторы используемые в области телекоммуникации и для аварийного освещения. Электролит, как и в предыдущем случае гелевый. В электродах содержится кальций, благодаря которому срок службы такого типа батарей – 20 лет.
- OPzS – катод таких аккумуляторов имеет трубчатую структуру. Это существенно повышает циклический ресурс этого типа батарей. Служит также около 20 лет. Выпускается в виде АКБ с напряжением от 2 до 125 В.
Литий-ионные аккумуляторы
Был впервые выпущен Sony в 1991 году и с тех пор активно применяется в бытовой технике, электронных устройствах. Практически все мобильные телефоны, ноутбуки, фотоаппараты и видеокамеры оснащены таким видом батарей. Роль катода здесь играет литий-ферро-фосфатная пластина. Отрицательный анод – каменноугольный кокс. Положительный ион лития переносит заряд в таких батареях. Он может проникать в кристаллическую решетку других материй и образовывать с ними химическую связь. Преимуществом этого типа является высокая энергоемкость, низкий саморазряд и отсутствие нужды в обслуживании.
Литий-ионные аккумуляторные батареи также, как и их свинцовые аналоги имеют большое количество подтипов. В данном случае подтипы отличаются между собой составом катода и анода. Напряжение литий-ионных аккумуляторов варьируется в пределах от 2,4 до 3,7 В.
Источник
—>Автозапчасти и СТО —>
Знаете ли вы, что первые автомобили были именно электрическими и использовали свинцово-кислотные аккумуляторы? То, что мы привыкли считать машинами будущего – электромобили – появились до изобретения двигателя внутреннего сгорания (ДВС). С тех пор прошло больше 100 лет, но современный АКБ автомобильный изменился только качественно, оставшись принципиально таким же, как и столетие назад.
Сегодня аккумулятор в автомобиле считается расходником, требующим периодической замены. Сколько именно проработает АКБ – вопрос к качеству изготовления, режиму работы, даже к состоянию дорог, но рано или поздно его меняют на «свежий».
Аккумулятор — химический источник тока, в котором энергия химической реакции многократно преобразуется в электрическую и наоборот. Таким образом, аккумулятор, имея возможность преобразовывать химическую энергию в электрическую, способен запасать ее и хранить в течение длительного времени. Заряжаясь, аккумулятор накапливает электрическую энергию, разряжаясь, отдает ее потребителю.
Первый аккумулятор (прототип современного свинцово-кислотного) был создан в 1860 г. Гастоном Планте и представлял собой две свинцовые полосы, разделенные пористым изолятором и помещенные в раствор серной кислоты. Выполненный по такой схеме единичный аккумуляторный элемент способен обеспечивать напряжение на выходе около 2 вольт. Емкость такого аккумулятора была невелика, и рабочие характеристики достигались только после многократных зарядно-разрядных циклов. Аккумулятор, аналогичный по своей конструкции современному, был создан в 1881 г. Пластины в нем представляли собой пакеты свинцовых решеток с запрессованной в них активной массой — пастой двуокиси свинца. Точно также и в современном свинцово-кислотном аккумуляторе активными веществами являются свинец и двуокись свинца, а электролитом — водный раствор серной кислоты.
Положительно заряженная пластина (электрод) представляет собой свинцовую решетку с активной массой из двуокиси свинца (PbO2), а электрод со знаком минус — решетку с активной массой из губчатого свинца (Pb). Во избежание возникновения короткого замыкания между пластинами, их разделяют пористыми сепараторами из изоляционного материала. Собранные блоки помещаются в корпус и заливаются электролитом (раствором серной кислоты плотностью 1.27-1.29 г/см 3 ).
Если к аккумулятору подключить нагрузку, то свинцовые пластины с активной массой, электролит и нагрузка образуют замкнутую цепь. Внутри аккумулятора начинается химическая реакция, в результате которой активная масса обоих электродов начнет менять первоначальный состав, преобразуясь из губчатого свинца и его двуокиси в сернокислый свинец (сульфат свинца PbSO4), а плотность электролита начинает падать. В итоге, в цепи образуется направленное движение ионов, и течет электрический ток. Такой процесс представляет собой разряд аккумулятора. При подключении к аккумулятору внешнего источника тока начинается обратный процесс — заряд. При заряде активная масса пластин восстанавливает свой первоначальный состав, плотность электролита растет. Эти химические процессы можно описать следующими уравнениями:
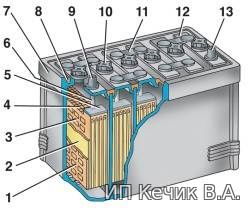 | 1 – отpицательная пластина; 2 – сепаpатоp; 3 – положительная пластина; 4 – пpедохpанительная сетка; 5 – баpетка; 6 – штыpь; 7 – моноблок; 8 – уплотнительная мастика; 9 – положительный вывод; 10 – пpобка наливного отвеpстия; 11 – межэлементная пеpемычка; 12 – кpышка; 13 – отpицательный вывод | — на положительной пластине: — на отрицательной пластине: Pb + H2SO4 = PbSO4+ H2 — 2e |
Батареи первого поколения — батареи с жидким электролитом
Активной массой положительного электрода обычной батареи служит двуокись свинца, отрицательного — чистый свинец, а электролитом — водный раствор серной кислоты. При разряде батареи активные массы пластин вступают в химическую реакцию с электролитом, вырабатывая электрический ток. При этом они преобразуются в сульфат свинца, а в электролит выделяется вода. При заряде происходит обратный процесс.
Для повышения твердости и коррозионной стойкости электродов свинцовые решетки, удерживающие активную массу, сначала легировали добавками сурьмы и мышьяка. Но сурьма способствует повышенному расходу воды и снижению ЭДС аккумуляторной батареи в процессе эксплуатации. Такое неудобство, как необходимость обслуживания классических батарей, заставила производителей искать способы упрощения эксплуатации. Сначала было снижено содержание сурьмы в пластинах, затем из отрицательных пластин сурьму вытеснил кальций. Гибридные АКБ продолжали требовать долива воды, но уже гораздо реже. Применение кальция в положительных пластинах привело к появлению батарей, теоретически не требующих долива на протяжении всего срока эксплуатации. Однако, кальциевые батареи имеют другой недостаток: они плохо переносят глубокие разряды. Чтобы повысить устойчивость АКБ к глубоким разрядам, в свинцово-кальциевый сплав положительных пластин стали добавлять серебро (Ag). Так возникли самые распространенные на сегодняшний день необслуживаемые АКБ.
Батареи второго поколения — герметизированные гелевые батареи (Gelled Electrolite)
В таких батареях кислотный электролит находится в гелеобразном состоянии благодаря добавлению в него соединений кремния. Гелевый электролит позволяет добиться полной герметичности батареи, так как все газовыделение происходит внутри сильно развитой системы пор в массе геля. Это решает проблему необслуживаемости АКБ.
Однако аккумуляторы с загущенным электролитом имеют несколько худшие нагрузочные характеристики по сравнению с классическими АКБ: большие токи с них снять сложнее из-за более высокого внутреннего сопротивления. Батареи с жидким электролитом лучше работают при высоких токах нагрузки при коротких режимах. Кроме того, гелевые батареи критичны к температуре окружающей среды и стабильности зарядного напряжения. Для их подзаряда нужно использовать зарядные устройства, обеспечивающие нестабильность напряжения заряда не хуже +/- 1% для предотвращения обильного газовыделения.
Батареи типа GEL наиболее устойчивы к глубоким разрядам и не нуждаются в обслуживании в течение всего срока службы при нормальных условиях эксплуатации. Но при их нарушении происходит быстрое старение батареи.
Батареи третьего поколения — герметизированные батареи с абсорбированным сепараторами электролитом AGM (Absorptive Glass Mat)
AGM-технология вновь вернулась к жидкой кислоте, но теперь электролит удерживается в порах сепаратора из ультратонких стеклянных волокон, размещенных между электродами. Такой сепаратор представляет собой пористую систему, в которой каппилярные силы удерживают электролит. При этом количество электролита дозируется так, чтобы мелкие поры были заполнены, а крупные оставались свободными для свободной циркуляции газов. Принцип рециркуляции такой же, как у гелевых АКБ: блуждая по порам сепаратора, газы успевают «вернуться» в электролит, не покидая корпус аккумулятора. Таким образом, AGM батареи также не требуют обслуживания в течение всего срока эксплуатации.
Конструкция AGM батарей позволяет не только герметизировать корпус, но и сохранить работоспособность батареи даже в случае повреждений наружной оболочки. Они нечувствительны к колебаниям температуры, долговечны и виброустойчивы.
Но главное преимущество таких батарей — в стойкости к глубоким разрядам. Происходит это за счет повышенной плотности сборки блока пластин и удержания активной массы. Электролит «связан», и разряд аккумулятора не сопровождается его выпариванием с последующим окислением пластин, как это случается с традиционными АКБ.
Но, как и гелевые, AGM батареи чувствительны к превышению зарядного напряжения, только причиной здесь является существенно меньшее количество электролита в них. Поэтому единственным условием для длительной эксплуатации такого рода аккумуляторов является правильный выбор зарядного устройства.
Источник
Что такое аккумулятор?
Аккумулятор — химический источник тока, в котором энергия химической реакции многократно преобразуется в электрическую и наоборот. Таким образом, аккумулятор, имея возможность преобразовывать химическую энергию в электрическую, способен запасать ее и хранить в течение длительного времени. Заряжаясь, аккумулятор накапливает электрическую энергию, разряжаясь, отдает ее потребителю.
Первый аккумулятор (прототип современного свинцово-кислотного) был создан в 1860 г. Гастоном Планте и представлял собой две свинцовые полосы, разделенные пористым изолятором и помещенные в раствор серной кислоты. Выполненный по такой схеме единичный аккумуляторный элемент способен обеспечивать напряжение на выходе около 2 вольт. Емкость такого аккумулятора была невелика, и рабочие характеристики достигались только после многократных зарядно-разрядных циклов. Аккумулятор, аналогичный по своей конструкции современному, был создан в 1881 г. Пластины в нем представляли собой пакеты свинцовых решеток с запрессованной в них активной массой — пастой двуокиси свинца. Точно также и в современном свинцово-кислотном аккумуляторе активными веществами являются свинец и двуокись свинца, а электролитом — водный раствор серной кислоты.
Положительно заряженная пластина (электрод) представляет собой свинцовую решетку с активной массой из двуокиси свинца (PbO2), а электрод со знаком минус — решетку с активной массой из губчатого свинца (Pb). Во избежание возникновения короткого замыкания между пластинами, их разделяют пористыми сепараторами из изоляционного материала. Собранные блоки помещаются в корпус и заливаются электролитом (раствором серной кислоты плотностью 1.27-1.29 г/см 3 ).
Если к аккумулятору подключить нагрузку, то свинцовые пластины с активной массой, электролит и нагрузка образуют замкнутую цепь. Внутри аккумулятора начинается химическая реакция, в результате которой активная масса обоих электродов начнет менять первоначальный состав, преобразуясь из губчатого свинца и его двуокиси в сернокислый свинец (сульфат свинца PbSO4), а плотность электролита начинает падать. В итоге, в цепи образуется направленное движение ионов, и течет электрический ток. Такой процесс представляет собой разряд аккумулятора. При подключении к аккумулятору внешнего источника тока начинается обратный процесс — заряд. При заряде активная масса пластин восстанавливает свой первоначальный состав, плотность электролита растет. Эти химические процессы можно описать следующими уравнениями:
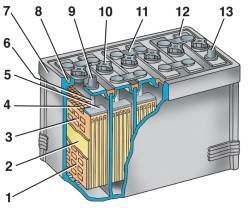 | 1 – отpицательная пластина; 2 – сепаpатоp; 3 – положительная пластина; 4 – пpедохpанительная сетка; 5 – баpетка; 6 – штыpь; 7 – моноблок; 8 – уплотнительная мастика; 9 – положительный вывод; 10 – пpобка наливного отвеpстия; 11 – межэлементная пеpемычка; 12 – кpышка; 13 – отpицательный вывод | — на положительной пластине: — на отрицательной пластине: Pb + H2SO4 = PbSO4+ H2 — 2e |
Батареи первого поколения — батареи с жидким электролитом
Активной массой положительного электрода обычной батареи служит двуокись свинца, отрицательного — чистый свинец, а электролитом — водный раствор серной кислоты. При разряде батареи активные массы пластин вступают в химическую реакцию с электролитом, вырабатывая электрический ток. При этом они преобразуются в сульфат свинца, а в электролит выделяется вода. При заряде происходит обратный процесс.
Для повышения твердости и коррозионной стойкости электродов свинцовые решетки, удерживающие активную массу, сначала легировали добавками сурьмы и мышьяка. Но сурьма способствует повышенному расходу воды и снижению ЭДС аккумуляторной батареи в процессе эксплуатации. Такое неудобство, как необходимость обслуживания классических батарей, заставила производителей искать способы упрощения эксплуатации. Сначала было снижено содержание сурьмы в пластинах, затем из отрицательных пластин сурьму вытеснил кальций. Гибридные АКБ продолжали требовать долива воды, но уже гораздо реже. Применение кальция в положительных пластинах привело к появлению батарей, теоретически не требующих долива на протяжении всего срока эксплуатации. Однако, кальциевые батареи имеют другой недостаток: они плохо переносят глубокие разряды. Чтобы повысить устойчивость АКБ к глубоким разрядам, в свинцово-кальциевый сплав положительных пластин стали добавлять серебро (Ag). Так возникли самые распространенные на сегодняшний день необслуживаемые АКБ.
Батареи второго поколения — герметизированные гелевые батареи (Gelled Electrolite)
В таких батареях кислотный электролит находится в гелеобразном состоянии благодаря добавлению в него соединений кремния. Гелевый электролит позволяет добиться полной герметичности батареи, так как все газовыделение происходит внутри сильно развитой системы пор в массе геля. Это решает проблему необслуживаемости АКБ.
Однако аккумуляторы с загущенным электролитом имеют несколько худшие нагрузочные характеристики по сравнению с классическими АКБ: большие токи с них снять сложнее из-за более высокого внутреннего сопротивления. Батареи с жидким электролитом лучше работают при высоких токах нагрузки при коротких режимах. Кроме того, гелевые батареи критичны к температуре окружающей среды и стабильности зарядного напряжения. Для их подзаряда нужно использовать зарядные устройства, обеспечивающие нестабильность напряжения заряда не хуже +/- 1% для предотвращения обильного газовыделения.
Батареи типа GEL наиболее устойчивы к глубоким разрядам и не нуждаются в обслуживании в течение всего срока службы при нормальных условиях эксплуатации. Но при их нарушении происходит быстрое старение батареи.
Батареи третьего поколения — герметизированные батареи с абсорбированным сепараторами электролитом AGM (Absorptive Glass Mat)
AGM-технология вновь вернулась к жидкой кислоте, но теперь электролит удерживается в порах сепаратора из ультратонких стеклянных волокон, размещенных между электродами. Такой сепаратор представляет собой пористую систему, в которой каппилярные силы удерживают электролит. При этом количество электролита дозируется так, чтобы мелкие поры были заполнены, а крупные оставались свободными для свободной циркуляции газов. Принцип рециркуляции такой же, как у гелевых АКБ: блуждая по порам сепаратора, газы успевают «вернуться» в электролит, не покидая корпус аккумулятора. Таким образом, AGM батареи также не требуют обслуживания в течение всего срока эксплуатации.
Конструкция AGM батарей позволяет не только герметизировать корпус, но и сохранить работоспособность батареи даже в случае повреждений наружной оболочки. Они нечувствительны к колебаниям температуры, долговечны и виброустойчивы.
Но главное преимущество таких батарей — в стойкости к глубоким разрядам. Происходит это за счет повышенной плотности сборки блока пластин и удержания активной массы. Электролит «связан», и разряд аккумулятора не сопровождается его выпариванием с последующим окислением пластин, как это случается с традиционными АКБ.
Но, как и гелевые, AGM батареи чувствительны к превышению зарядного напряжения, только причиной здесь является существенно меньшее количество электролита в них. Поэтому единственным условием для длительной эксплуатации такого рода аккумуляторов является правильный выбор зарядного устройства.
Источник



