- Строение атома железа
- Общие сведения о строении атома железа
- Электронное строение атома железа
- Примеры решения задач
- Электронная конфигурация атома железа (Fe)
- Валентные электроны железа
- Электронные формулы других элементов
- Железо: строение атома, схема и примеры. Электронное строение атома железа
- Положение в ПС
- Особенности строения атома
- Нахождение в природе
- Значение для растений и животных
- Физические свойства
- Разновидности железа
- Варианты получения
- Особенности химических свойств
- Железо, свойства атома, химические и физические свойства
- Железо, свойства атома, химические и физические свойства.
- Атом и молекула железа. Формула железа. Строение атома железа:
- Изотопы и модификации железа:
- Свойства железа (таблица): температура, плотность, давление и пр.:
Строение атома железа
Общие сведения о строении атома железа
Относится к элементам d — семейства. Металл. Обозначение – Fe. Порядковый номер – 26. Относительная атомная масса – 55,849 а.е.м.
Электронное строение атома железа
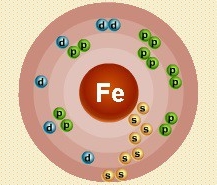
Атом железа состоит из положительно заряженного ядра (+26), внутри которого есть 26 протонов и 30 нейтронов, а вокруг, по четырем орбитам движутся 26 электронов.
Рис.1. Схематическое строение атома железа.
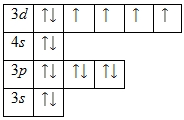
Распределение электронов по орбиталям выглядит следующим образом:
Энергетическая диаграмма основного состояния принимает следующий вид:
Примеры решения задач
| Задание | Электронная формула элемента имеет окончание …3p 3 .Напишите полную электронную формулу этого элемента и определите его порядковый номер в Периодической системе Д.И. Менделеева. |
| Ответ | Полная электронная формула будет выглядеть следующим образом: |
Порядковый номер элемента можно найти, сложив все электроны атома, вне зависимости от того, какие орбитали они занимают. Значит это 15-й элемент – фосфор.
| Задание | Определите число неспаренных электронов в атомах следующих элементов: а) магния; б) марганца; в) брома. |
| Ответ | а) Электронная конфигурация атома магния: |
1s 2 2s 2 2p 6 3s 2 .
Неспаренных электронов нет:
б) Электронная конфигурация атома марганца:
Источник
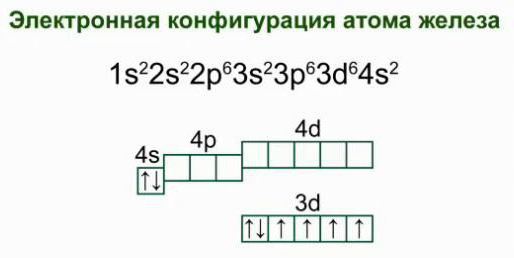
Электронная конфигурация атома железа (Fe)
Fe (железо) — элемент с прядковым номером 26 в периодической системе. Находится в IV периоде. Температура плавления: 1535 ℃. Плотность: 7.87 г/см 3 .
Электронная формула атома железа в порядке возрастания энергий орбиталей:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6
Электронная формула атома железа в порядке следования уровней:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
Сокращенная электронная конфигурация Fe:
[Ar] 3d 6 4s 2
Ниже приведена электронно-графическая схема атома железа
Валентные электроны железа
Количество валентных электронов в атоме железа — 8.
Ниже приведены их квантовые числа (N — главное, L — орбитальное, M — магнитное, S — спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 4 | 0 | 0 | +1/2 |
| s | 4 | 0 | 0 | -1/2 |
| d | 3 | 2 | -2 | +1/2 |
| d | 3 | 2 | -1 | +1/2 |
| d | 3 | 2 | 0 | +1/2 |
| d | 3 | 2 | 1 | +1/2 |
| d | 3 | 2 | 2 | +1/2 |
| d | 3 | 2 | -2 | -1/2 |
Степени окисления, которые может проявлять железо: +1, +2, +3, +4, +5, +6
Электронные формулы других элементов
2020 Ваш онлайн — калькуляторы, таблицы и формулы
Источник
Железо: строение атома, схема и примеры. Электронное строение атома железа
Рассмотрим электронное строение атома железа, а также его расположение в таблице Менделеева. Выявим основные физические и химические свойства данного элемента, области использования.
Положение в ПС
Железо является д-элементом 8 группы (побочной подгруппы). Имеет 26 порядковый номер, относительную атомную массу — 56, в его атоме содержится 26 протонов, 26 электронов, а также 30 нейтронов. Данный металл имеет среднюю химическую активность, проявляет восстановительные свойства. Характерные степени окисления: +2, +3.
Особенности строения атома
Что собой представляет электронная схема строения атома железа? Если рассматривать распределение электронов по энергетическим уровням, получим следующий вариант:
2е; 8е; 14 е; 2е. Такое строение электронной оболочки атома железа свидетельствует о его расположении в побочной подгруппе, подтверждает принадлежность к д-семейству элементов.
Нахождение в природе
Железо является одним из наиболее распространенных в природе химических элементов. В земной коре его процентное содержание составляет около 5,1%. В большем количестве в недрах нашей планеты присутствует только три элемента: кремний, алюминий, кислород.
Железные руды встречаются в разных регионах Земли. Алхимиками были обнаружены соединения данного металла в почвах. При производстве железа выбирают руды, в которых его содержание превышает 30 процентов.
В магнитном железняке содержится около семидесяти двух процентов металла. Основные месторождения магнетита располагаются в Курской магнитной аномалии, а также на Южном Урале. В кровавике процентное количество железа достигает 65 процентов. Гематит был обнаружен в Криворожском районе.
Значение для растений и животных
Какую роль в живых организмах выполняет железо? Строение атома поясняет его восстановительные свойства. Данный химический элемент входит в состав гемоглобина, придавая ему характерную красную окраску. Около трех граммов чистого железа, большая часть которого включена в гемоглобин, обнаружена в организме взрослого человека. Основным предназначением является перенос к тканям из легких активного кислорода, а также вывод образующегося углекислого газа.
Необходим этот металл и растениям. Входя в состав цитоплазмы, он принимает активное участие в процессах фотосинтеза. Если в растении недостаточно железа, его листья имеют белую окраску. При минимальных подкормках солями железа листья растений приобретают зеленый цвет.
Физические свойства
Мы рассмотрели строение атома железа. Схема подтверждает наличие у данного элемента металлического блеска (есть валентные электроны). У серебристо-белого металла довольно высокая температура плавления (1539 градусов по Цельсию). Благодаря хорошей пластичности данный металл легко поддается прокатке, штамповке, ковке.
Способность к намагничиванию и размагничиванию, характерная для железа, сделала его отличным материалом для производства сердечников мощных электромагнитов в разных аппаратах и электрических машинах.
Насколько активно железо? Строение атома показывает наличие на внешнем уровне двух электронов, которые будут отданы в ходе химической реакции. Для увеличения его твердости и прочности осуществляют дополнительную прокатку и закалку металла. Такие процессы не сопровождаются изменением строения атома.
Разновидности железа
Электронное строение атома железа, схема которого была рассмотрена выше, объясняет его химические характеристики. В технически чистом металле, являющемся низкоуглеродистой сталью, основным компонентом является железо. В качестве примесей выявлено около 0,04 процента углерода, также присутствуют фосфор, азот, сера.
Химически чистое железо по своим внешним параметрам аналогично платине. Оно обладает повышенной стойкостью к процессам коррозии, устойчиво к действию кислот. При малейшем введении примесей в чистый металл его уникальные характеристики исчезают.
Варианты получения
Строение атомов алюминия и железа свидетельствуют о принадлежности амфотерного алюминия к главной подгруппе, возможности использования его в процессе выделения железа из его оксидов. Алюмотермия, осуществляемая при повышенной температуре, позволяет выделять чистый металл из природных руд. Кроме алюминия в качестве сильных восстановителей выбирают водород, оксид углерода (2), уголь.
Особенности химических свойств
Какие химические свойства имеет железо? Строение атома поясняет его восстановительную активность. Для железа характерно образование двух рядов соединений, имеющих степени окисления +2, +3.
Во влажном воздухе происходит процесс ржавления (коррозии) металла, в результате образуется гидроксид железа (3). С кислородом нагретая железная проволока реагирует с появлением черного порошка оксида железа (2,3), называемого железной окалиной.
При высокой температуре металл способен взаимодействовать с парами воды, образуя при этом смешанный оксид. Процесс сопровождается выделением водорода.
Реакция с неметаллами происходит только при предварительном нагревании исходных компонентов.
Железо можно растворить в разбавленной серной или соляной кислотах без предварительного подогрева смеси. Концентрированные серная и соляная кислоты пассивируют этот металл.
Какими еще химическими свойствами обладает железо? Строение атома данного элемента свидетельствует о его средней активности. Это подтверждается расположением железа до водорода (Н2) в ряду напряжений. Следовательно, оно может вытеснять из солей все металлы, располагающиеся правее в ряду Бекетова. Так, в реакции с хлоридом меди (2), осуществляемой при нагревании, происходит выделение чистой меди и получение раствора хлорида железа (2).
Основную часть всего железа используют в производстве чугуна и стали. В чугуне процентное содержание углерода составляет 3-4 процента, в стали – не больше 1,4 процентов. Этот неметалл выполняет функцию элемента, повышающего прочность соединения. Кроме того, он позитивно воздействует на коррозионные свойства сплавов, повышает устойчивость материала к повышенной температуре.
Добавки ванадия необходимы для повышения механической прочности стали. Хром увеличивает стойкость к действию агрессивных химических веществ.
Ферромагнитные свойства этого химического элемента сделали его востребованным в промышленных установках, включающих в состав электромагниты. Кроме того, железо нашло свое использование и в сувенирной промышленности. На его основе изготавливают различные сувениры, например красочные магнитики на холодильник.
Прочность и ковкость позволяют применять металл для создания брони, различных видов оружия.
Хлорид железа (3) применяют для очистки воды от примесей. В медицине 26 элемент периодической системы Менделеева применяют при лечении такого заболевания, как анемия. В случае недостатка красных кровяных телец возникает быстрая утомляемость, кожа приобретает неестественный бледный цвет. Препараты железа помогают устранять подобную проблему, возвращать организм к полноценной деятельности. Особое значение железо имеет для деятельности щитовидной железы, печени. Чтобы в организме человека не возникало серьезных проблем, достаточно употреблять в день около 20 мг этого металла.
Источник
Железо, свойства атома, химические и физические свойства
Железо, свойства атома, химические и физические свойства.
55,845(2) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
Железо — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Расположен в 8-й группе (по старой классификации — побочной подгруппе восьмой группы), четвертом периоде периодической системы.
Физические свойства железа
Атом и молекула железа. Формула железа. Строение атома железа:
Железо (лат. Ferrum) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Fe и атомным номером 26. Расположен в 8-й группе (по старой классификации – побочной подгруппе восьмой группы), четвертом периоде периодической системы.
Железо – металл. Относится к группе переходных металлов. Относится к чёрным металлам .
Как простое вещество железо при нормальных условиях представляет собой ковкий, вязкий металл серебристо-белого цвета с сероватым оттенком с высокой химической реакционной способностью. Собственно железом обычно называют его сплавы с малым содержанием примесей (до 0,8 %), которые сохраняют мягкость и пластичность чистого металла. На практике чаще применяются сплавы железа с углеродом: сталь (до 2,14 вес. % углерода) и чугун (более 2,14 вес. % углерода), а также нержавеющая (легированная) сталь с добавками легирующих металлов (хром, марганец, никель и др.).
Молекула железа одноатомна.
Химическая формула железа Fe.
Электронная конфигурация атома железа 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 . Потенциал ионизации (первый электрон) атома железа равен 762,47 кДж/моль (7,9024681(12) эВ).
Строение атома железа. Атом железа состоит из положительно заряженного ядра (+26), вокруг которого по четырем оболочкам движутся 26 электронов. При этом 24 электрона находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку железо расположено в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома железа на 3d-орбитали находится два спаренных и четыре неспаренных электрона. На внешнем энергетическом уровне атома железа – на s-орбитали находится два спаренных электрона. В свою очередь ядро атома железа состоит из 26 протонов и 30 нейтронов.
Радиус атома железа (вычисленный) составляет 156 пм.
Атомная масса атома железа составляет 55,845(2) а. е. м.
Железо – один из самых распространённых в земной коре металлов – занимает четвертое место. Содержание в земной коре железа составляет 6,3 % (по массе). По этому показателю железо уступает только кислороду, кремнию и алюминию.
Изотопы и модификации железа:
Свойства железа (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Железо |
| 102 | Прежнее название | |
| 103 | Латинское название | Ferrum |
| 104 | Английское название | Iron |
| 105 | Символ | Fe |
| 106 | Атомный номер (номер в таблице) | 26 |
| 107 | Тип | Металл |
| 108 | Группа | Амфотерный, переходный, чёрный металл |
| 109 | Открыт | Известно с глубокой древности |
| 110 | Год открытия | до 5000 года до н. э. |
| 111 | Внешний вид и пр. | Ковкий, вязкий металл серебристо-белого цвета с сероватым оттенком |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
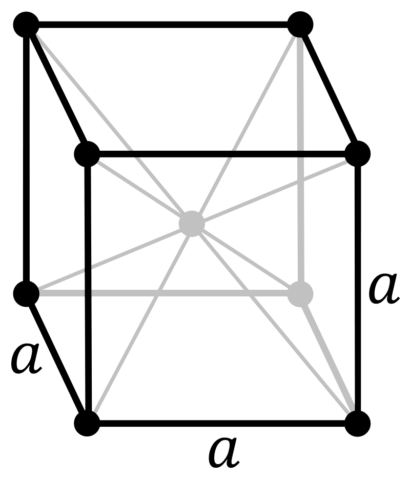
| 114 | Аллотропные модификации | 5 аллотропных модификации железа: – α-железо (феррит) с кубической объемно-центрированной кристаллической решёткой и свойствами ферромагнетика, – β-железо с кубической объёмно-центрированной кристаллической решёткой, отличающееся от α-железа параметрами кристаллической решётки и свойствами парамагнетика. β-железо служит для обозначения α-железа выше точки Кюри (точка Кюри железа 769 °C), – γ-железо (аустенит) с кубической гранецентрированной кристаллической решёткой, – δ-железо с кубической объёмно-центрированной кристаллической решёткой, – ε-железо с гексагональной плотноупакованной кристаллической решёткой |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга* | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 6,3 % |
| 120 | Содержание в морях и океанах (по массе) | 3,0·10 -7 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,11 % |
| 122 | Содержание в Солнце (по массе) | 0,1 % |
| 123 | Содержание в метеоритах (по массе) | 0,22 % |
| 124 | Содержание в организме человека (по массе) | 0,006 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 55,845(2) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 |
| 203 | Электронная оболочка | K2 L8 M14 N2 O0 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 156 пм |
| 205 | Эмпирический радиус атома* | 140 пм |
| 206 | Ковалентный радиус* | 123 пм – low-spin, 152 пм – high-spin |
| 207 | Радиус иона (кристаллический) | Fe 2+ low spin (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | |
| 209 | Электроны, Протоны, Нейтроны | 26 электронов, 26 протонов, 30 нейтронов |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 4 |
| 212 | Группа в периодической таблице | 8-ая группа (по старой классификации – побочная подгруппа 8-ой группы) |
| 213 | Эмиссионный спектр излучения |  |
| 300 | Химические свойства | |
| 301 | Степени окисления | -4, -2, -1, 0, +1, +2 , +3 , +4, +5, +6 , +7 |
| 302 | Валентность | II, III |
| 303 | Электроотрицательность | 1,83 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 762,47 кДж/моль (7,9024681(12) эВ) |
| 305 | Электродный потенциал | Fe 2+ + 2e – → Fe, E o = -0,440 В, Fe 3+ + e – → Fe 2+ , E o = +0,771, Fe 3+ + 3e – → Fe, E o = -0,037 В |
| 306 | Энергия сродства атома к электрону | 15,7 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность | 7,874 г/см 3 (при 0 °C/20 °C и иных стандартных условиях , состояние вещества – твердое тело), 6,98 г/см 3 (при температуре плавления 1538 °C и иных стандартных условиях , состояние вещества – жидкость), 6,9 г/см 3 (при 1589 °C и иных стандартных условиях , состояние вещества – жидкость) |
| 402 | Температура плавления* | 1538 °C (1811 K, 2800 °F) |
| 403 | Температура кипения* | 2861 °C (3134 K, 5182 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 13,81 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 340 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,448 Дж/г·K (при 25 °C), 0,64 Дж/г·K (при 0-1000 °C) |
| 410 | Молярная теплоёмкость* | 25,10 Дж/(K·моль) |
| 411 | Молярный объём | 7,1 см³/моль |
| 412 | Теплопроводность | 80,4 Вт/(м·К) (при стандартных условиях ), 80,4 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-железо (феррит) |
| 512 | Структура решётки | Кубическая объёмно-центрированная |
| 513 | Параметры решётки | 2,866 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 460 K |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 511 | Кристаллическая решётка #2 | γ-железо (аустенит) |
| 512 | Структура решётки | Кубическая гранецентрированная |
| 513 | Параметры решётки | 3,656 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 521 | Кристаллическая решётка #3 | δ-железо |
| 522 | Структура решётки | Кубическая объёмно-центрированная |
| 523 | Параметры решётки | 2,93 Å |
| 524 | Отношение c/a | |
| 525 | Температура Дебая | |
| 526 | Название пространственной группы симметрии | Im_ 3m |
| 527 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7439-89-6 |
205* Эмпирический радиус атома железа согласно [1] и [3] составляет 126 пм.
206* Ковалентный радиус железа согласно [1] составляет 132±3 пм (low-spin) и 152±6 пм (high-spin), ковалентный радиус железа согласно [3] [Россия] составляет 117 пм.
402* Температура плавления железа согласно [3] и [4] составляет 1538,85 °C (1812 К, 2801,93 °F) и 1539 °C (1812,15 К, 2802,2 °F) соответственно.
403* Температура кипения железа согласно [4] составляет 2870 °C (3143,15 К, 5198 °F).
407* Удельная теплота плавления (энтальпия плавления ΔHпл) железа согласно [3] и [4] составляет 13,8 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) железа согласно [4] составляет 350 кДж/моль.
410* Молярная теплоемкость железа согласно [3] составляет 25,14 Дж/(K·моль).
Источник