- Устройство автомобилей
- Аккумуляторные батареи
- Принцип работы свинцового аккумулятора
- Устройство, принцип работы свинцово-кислотных АКБ
- Устройство типового свинцово-кислотного аккумулятора
- Принцип работы аккумулятора свинцово-кислотного типа
- Классификация свинцово-кислотных АКБ
- Достоинства и недостатки
- Сфера применения
Устройство автомобилей
Аккумуляторные батареи
Принцип работы свинцового аккумулятора
Источником электроэнергии на автомобиле при неработающем или работающем с малой частотой вращения коленчатого вала двигателе является аккумуляторная батарея. В настоящее время на автомобилях наиболее широко применяются свинцовые аккумуляторные батареи, состоящие из нескольких последовательно соединенных аккумуляторов. Применение кислотных аккумуляторов объясняется тем, что они обладают небольшим внутренним сопротивлением и способны в течение короткого промежутка времени (несколько секунд) отдавать ток силой в несколько сотен ампер, что необходимо для питания стартера при пуске двигателя.
Свинцовый аккумулятор электрической энергии был изобретен в 1859 году французским физиком Гастоном Планте. В последующие годы конструкция аккумулятора, особенно – химический состав его электродов (пластин) постоянно совершенствовалась. В настоящее время свинцовые аккумуляторы и аккумуляторные батареи широко применяются в разных областях техники в качестве накопителей электроэнергии (стартерные батареи, аварийные и резервные источники энергии и т. п.).
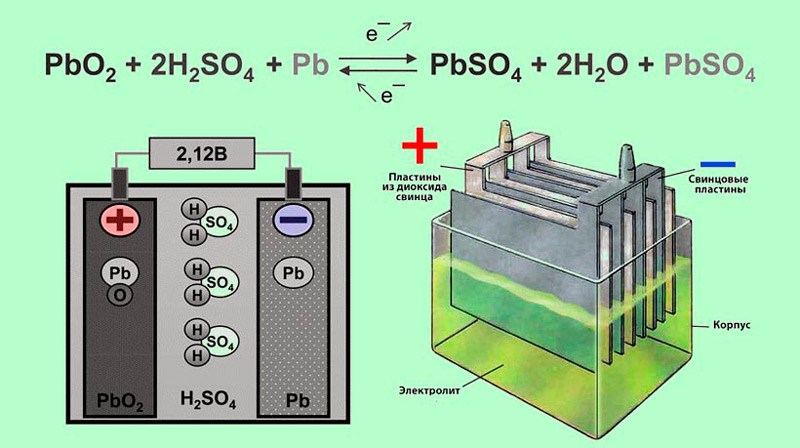
Конструктивно аккумулятор представляет собой емкость, наполненную электролитом, в которой размещены свинцовые электроды. В качестве электролита используется раствор серной кислоты и дистиллированной воды. Электроды выполнены в виде пластин, одна из которых изготовлена из губчатого свинца Pb, а вторая – из диоксида свинца PbO2. При взаимодействии электродов с электролитом между ними возникает разность потенциалов.
Принцип работы свинцово-кислотных аккумуляторов основан на электрохимических реакциях свинца и диоксида свинца в водном растворе серной кислоты.
При подключении к электродам аккумулятора внешней нагрузки начинается электрохимическая реакция взаимодействия оксида свинца и серной кислоты, при этом металлический свинец окисляется до сульфата свинца.
Во время разряда происходит восстановление диоксида свинца на положительном электроде (аноде) и окисление свинца на отрицательном электроде (катоде). При пропускании через электроды аккумулятора зарядного тока в нем протекают обратные реакции. При перезаряде аккумулятора, после исчерпания сульфата свинца начинается электролиз воды, при этом на аноде выделяется кислород, а на катоде — водород.
Электрохимические реакции (слева направо — при разряде, справа налево — при заряде):
Реакции на аноде:
Реакции на катоде:
Физические процессы, происходящие в аккумуляторе, объясняются свойством электролитического растворения металлов, которое заключается в переходе положительно заряженных ионов металла в раствор. Легкоокисляющиеся металлы (например, свинец) обладают этим свойством в большей степени, чем инертные металлы.
При погружении свинцового электрода в раствор электролита от него начнут отделяться положительно заряженные ионы свинца и переходить в раствор, при этом сам электрод будет заряжаться отрицательно.
По мере протекания процесса растет разность потенциалов раствора и электрода, и переход положительных ионов в раствор будет замедляться.
При какой-то определенной разности потенциалов электрода и раствора наступит равновесие между силой электролитической упругости растворения свинца, с одной стороны, и силами электростатического поля и осмотического давления — с другой.
В результате переход ионов свинца в электролит прекратится.
При погружении электрода, изготовленного из двуокиси свинца, в раствор серной кислоты наблюдается такой же процесс, но результат получается иной. Двуокись свинца в ограниченном количестве переходит в раствор, где при соединении с водой ионизируется на четырехвалентные ионы свинца Рв4+ и одновалентные ионы гидроксила ОН.
Четырехвалентные ионы свинца, осаждаясь на электроде, создают положительный потенциал относительно раствора. Серная кислота образует в воде практически только на ионы НO + и HSO4.
Таким образом, при разряде аккумулятора расходуется серная кислота, образуется вода, а на обоих электродах — сульфат свинца. При заряде процессы протекают в обратном направлении.
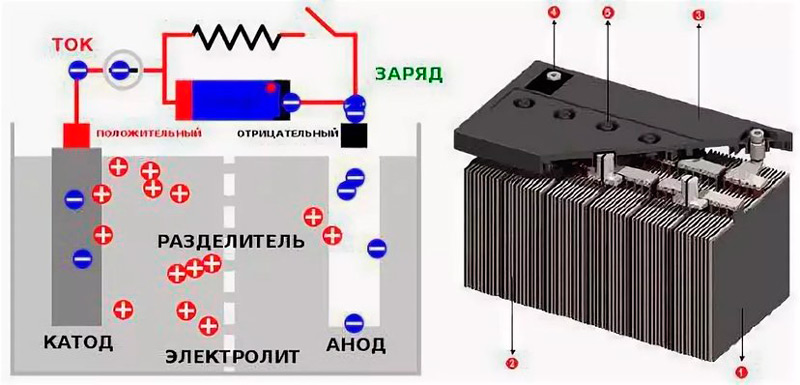
При подключении потребителей в аккумуляторе возникает разрядный ток. При этом ионы сернокислотного остатка SO4 соединяются со свинцом электродов и образуют на них сернокислый свинец PbSO4, а ионы водорода соединяются с кислородом, выделяясь на положительной пластине в виде воды.
В результате электроды покрываются сернокислым свинцом, а серная кислота разбавляется водой, т. е. при разряде аккумулятора плотность электролита уменьшается. Поэтому по плотности электролита можно судить о степени заряженности аккумуляторной батареи.
При прохождении электрического (зарядного) тока через аккумуляторную батарею протекают обратные электрохимические процессы. Ионы водорода, образующиеся в результате распада воды, взаимодействуют с сернокислым свинцом электродов.
Водород, соединяясь с сернистым осадком, образует серную кислоту, а на электродах восстанавливается губчатый свинец. Выделяющийся из воды кислород, соединяется со свинцом положительной пластины, образуя перекись свинца.
В результате этих процессов содержание воды в электролите уменьшается, а содержание кислоты увеличивается, что приводит к повышению плотности электролита.
По завершению процессов восстановления свинца на электродах заряд аккумулятора прекращается. При дальнейшем прохождении электрического тока через электролит начинается процесс электролиза (разложения) воды, при этом аккумулятор «закипает», и выделяющиеся пузырьки образуют смесь водорода и кислорода. Смесь этих газов является взрывоопасной, поэтому следует избегать перезаряда до появления электролизных явлений по разложению воды.
Кроме того, длительный перезаряд приводит к потере электролитом воды (испарению), в результате чего его плотность повышается и для корректировки требуется доливка дистиллированной воды.
При доливке воды необходимо помнить, что вода, попадающая в концентрированную серную кислоту, закипает и сильно разбрызгивает кислотные капли, что при попадании на открытое тело или одежду может привести к ожогам кожи, слизистых оболочек, прожигу одежды и другим неприятным последствиям.
При постоянном напряжении источника зарядного тока по мере увеличения степени заряженности аккумулятора повышается его ЭДС и, следовательно, уменьшается сила зарядного тока. Когда напряжение на клеммах источника тока будет равно ЭДС полностью заряженного аккумулятора плюс ЭДС поляризации, зарядный ток прекратится.
Среднее значение напряжения аккумулятора – 2 В. Поскольку электрооборудование современных автомобилей рассчитано для работы при напряжении в бортовой сети 12 или 24 В, аккумуляторы соединяют в батареи (по 6 или 12 шт.).
Важным параметром аккумулятора является его емкость, т. е. количество электрической энергии, которую способен отдать аккумулятор. Емкость – это произведение силы разрядного тока на продолжительность разрядки до предельно допустимого разряженного состояния. Измеряется емкость аккумулятора в ампер-часах (А×ч). Емкость аккумулятора зависит, в первую очередь, от активной площади его электродов.
Поэтому повышения емкости можно достичь увеличением поверхности электродов, что достигается использованием нескольких параллельно соединенных между собой пластин, а также применением пористого материала для их изготовления, что позволяет использовать в качестве активной массы не только поверхность, но и внутренний объем пластин.
Емкость аккумулятора не постоянна, она зависит от силы разрядного тока, температуры электролита и состояния активной поверхности пластин. При увеличении разрядного тока и понижении температуры электролита емкость аккумулятора уменьшается, что объясняется неполным протеканием электрохимических реакций разрядки в этих условиях, вследствие сокращения времени разрядки и повышения вязкости электролита при низких температурах.
Источник
Устройство, принцип работы свинцово-кислотных АКБ
Любой автомобиль не может нормально работать без аккумулятора, и дело не только в возможности пуска двигателя – современные гибридные и полностью электрические модели машин используют АКБ в качестве основной движущей силой.
И хотя разработки новых, более ёмких типов аккумуляторов не прекращаются, старые добрые свинцово-кислотные модели всё ещё остаются в тренде, по-прежнему являясь самым распространённым типом автомобильных батарей. Почему аккумуляторы, первые прототипы которых появились ещё в XIX веке, не собираются уходить на пенсию? Давайте разбираться.
Устройство типового свинцово-кислотного аккумулятора
Использование химических реакций для выработки электроэнергии – идея старая. Электролиз как явление был известен со времён Фарадея, и именно он лежит в основе работы АКБ кислотно-свинцового типа. Если конкретнее, то такими реакциями является взаимодействие свинца и водного раствора серной кислоты, а также последней с диоксидом свинца при определённом направлении тока.
Устройство классического свинцово-кислотного аккумулятора нельзя назвать сложным: батарея пластин, заключенная в пластиковом корпусе, погружена в электролит. Когда к аккумулятору подключить нагрузку, то во время разряда на анодных пластинах свинец связывается с сульфатным остатком, образуя сульфат свинца, на катоде происходит реакция восстановления диоксида свинца. Во время зарядки всё меняется: на аноде сульфатированный свинец распадается на чистый металл, а остаток связывается с водой, восстанавливая объёмы серной кислоты в электролите. Эта схема, состоящая из несложных химических операций, выполняемых поочерёдно, позволяет батарее служить источником питания достаточно долго.
Но баланс сил меняется, если одна из операций, зарядка или разрядка, становится превалирующей. При перезаряде количество сульфата свинца уменьшается, что становится причиной старта процесса электролиза. В результате электролит закипает, и такое явление само по себе опасное, поскольку выделяемые при этом газы – взрывоопасны. С этим явлением борются, обеспечивая постепенное падение заряда на клеммах АКБ при увеличении напряжения. Но существует и другая опасность – выкипание электролита, поскольку оголенные пластины быстро начинают разрушаться под воздействием кислорода. При сильном разряде пластины сульфатируются, покрываясь слоем сульфата свинца, который не преобразуется в чистый свинец при зарядке, снижая ёмкость батареи.

Именно ёмкость является главной характеристикой аккумулятора, определяя, какое количество электроэнергии способна отдавать батарея в единицу времени. Поскольку ёмкость находится в прямой зависимости от площади свинцовых пластин, увеличение этого параметра возможно несколькими способами: использование большего количества пластин и увеличением их размера. Но поскольку и то, и другое имеют ограничения, то конструкция и состав свинцово-кислотных АКБ эволюционируют в других направлениях, где добиться существенного прогресса очень сложно. Например, разработчики много экспериментируют с составом пластин, внося в свинец различные добавки.
Принцип работы аккумулятора свинцово-кислотного типа
Востребованность АКБ этого типа обусловлена простотой и надёжностью конструкции. Обладая невысоким внутренним сопротивлением, такие батареи способны генерировать ток номиналом в сотни ампер, а для автомобильного стартера важным являются именно такие характеристики – мощь, выдаваемая на протяжении небольшого отрезка времени.
Нельзя сказать, что с конца 19 века конструкция, характеристики и КПД свинцово-кислотных аккумуляторов не совершенствовались, этот процесс продолжается и поныне.
Но в целом принцип функционирования остался неизменным. Современное устройство состоит из комплекта свинцовых электродов, заключённых в общий корпус. Пластины изготавливаются из пористой, губчатой разновидности свинца, что необходимо для обеспечения химических реакций с участием возможно большего числа молекул, катодные пластины покрыты слоем диоксида свинца. Когда электролитическая жидкость, состоящая из водного раствора серной кислоты, взаимодействует с пластинами при подсоединении к АКБ нагрузки, возникает электрический заряд. При этом свинец присоединяет к себе сульфатный остаток, образуя сульфат свинца и воду, количество серной кислоты в электролите уменьшается со скоростью, пропорциональной нагрузке. Другими словами, при прокручивании стартера ёмкость падает очень быстро, а если в качестве нагрузки выступает магнитола, разряд будет происходить намного медленнее.
При зарядке аккумулятора происходят обратные химические реакции – сульфат свинца разлагается, образуя серную кислоту и чистый свинец, плотность электролита возрастает, теоретически такие циклы могли бы продолжаться бесконечно, но на практике со временем способность пластин к самовосстановлению падает.
Классификация свинцово-кислотных АКБ
Как мы уже отмечали, бесконечно улучшать характеристики аккумуляторов невозможно. Изменяя и улучшая одни параметры, приходится мириться с тем, что при этом страдают другие характеристики. Но именно этот принцип послужил основой для создания батарей, обладающих разными свойствами.
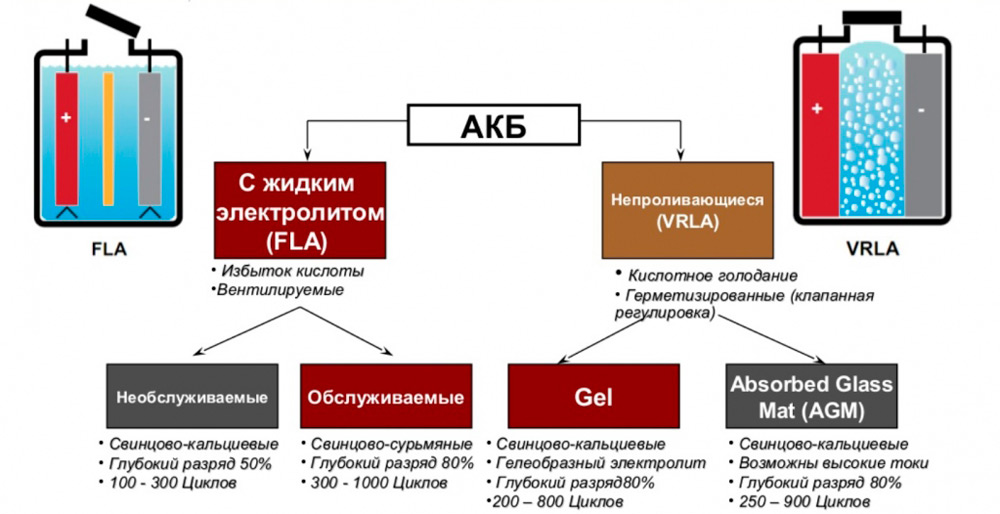
Так, в настоящее время все АКБ этого типа подразделяются не негерметичные (обслуживаемые) и герметичные.
У первых благодаря наличию отверстий в пробках может происходить потеря электролита вследствие его испарения, поэтому такие батареи требуют периодической проверки уровня электролитической жидкости и её долива в случае необходимости. Кроме того, негерметичные батареи боятся резких наклонов и тем более переворотов.
Более современная герметичная разновидность лишена этих недостатков, а проблема накопления взрывоопасных газов здесь решается использованием специальной системы их сброса. Но такие аккумуляторы практически не подлежат ремонту и восстановлению, в отличие от обслуживаемых. Впрочем, средний их срок эксплуатации всё равно больше, так что проблема скорее надуманная, чем реальная.
По основным характеристикам свинцово-кислотные батареи подразделяются на следующие типы:
- стартерные. Как следует из названия, предназначены для пуска двигателей, их главной особенностью является способность выдавать большие токи на протяжении короткого периода времени (эта характеристика называется током саморазряда);
- буферные батареи. Используются в качестве аварийного источника питания, их нормальное состояние – постоянно находиться в режиме подзарядки;
- АКБ длительного электроснабжения способны выдавать токи больших номиналов длительное время. Это достаточно массивные и крупные изделия, используемые для аварийного питания в особо важных сферах (например, в реанимационных отделениях).
По конструкции пластин и типу электролита свинцово-кислотные АКБ бывают следующих типов:
- жидкостные, самая распространённая разновидность. Обеспечивают количество циклов заряда-разряда на уровне 260-500;
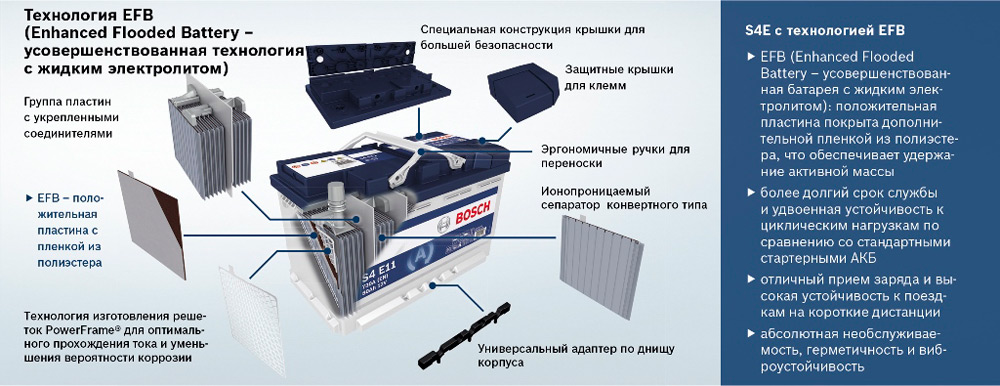
- батареи EFB обладают в целом лучшими характеристиками, в том числе и ресурсом (до 1000 циклов), но стоят достаточно дорого. Здесь электролит тоже жидкий, но его значительно меньше и пластины имеют другую конструкцию;
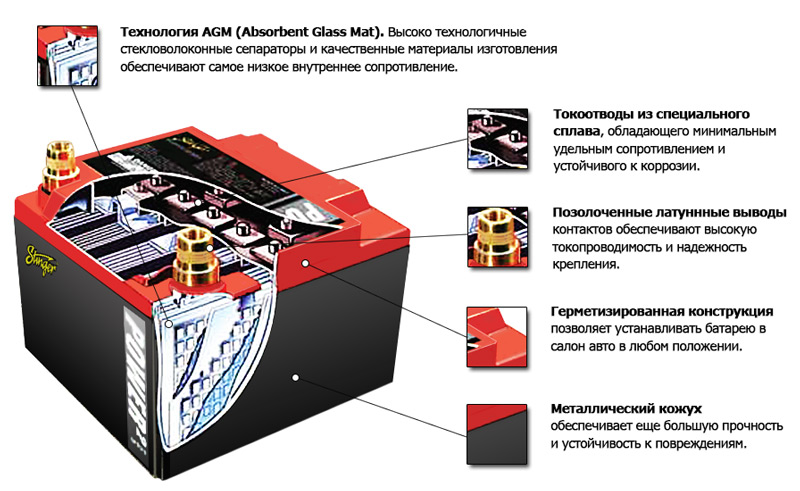
- AGM аккумуляторы известны тем, что электроды здесь облачены в стекловолоконные оболочки, препятствующие вытеканию электролита. Их достоинство – возможность быстрой зарядки и больший номинал вырабатываемого тока;
- гелевые аккумуляторы – полностью необслуживаемые, электролит здесь находится в гелеобразном виде, такие батареи можно устанавливать даже вертикально, они не боятся тряски и ударов.
Словом, совершенствование свинцово-кислотной технологии продолжается, пускай и эволюционным путём.
Достоинства и недостатки
Если говорить о плюсах и минусах аккумуляторный батарей свинцово-кислотного типа, то они хорошо известны.
Начнём, как обычно, с достоинств:
- благодаря простоте конструкции это самые дешёвые из всех разновидностей автомобильных АКБ;
- их легко утилизировать (в некоторых странах благодаря налаженной системе утилизации уровень повторного использования свинца при производстве аккумуляторов достигает 95-98%);
- по сравнению с батареями, в которых пластины изготовляются с применением других химических элементов, свинцово-кислотные отличаются способностью дольше удерживать заряд;
- необслуживаемые разновидности просты и неприхотливы в эксплуатации и не требует слежения за уровнем электролитической жидкости;
- у таких АКБ пусковой ток достаточно высокий, чтобы использовать их для пуска автомобильных моторов.
Но есть и трудноустранимые недостатки, над которыми исследователи бьются уже больше столетия:
- и свинец, и раствор серной кислоты – вещества, опасные с экологической точки зрения, поэтому такие аккумуляторы подлежат обязательной утилизации;
- при неконтролируемой зарядке возможен перегрев батареи, чреватый её взрывом;
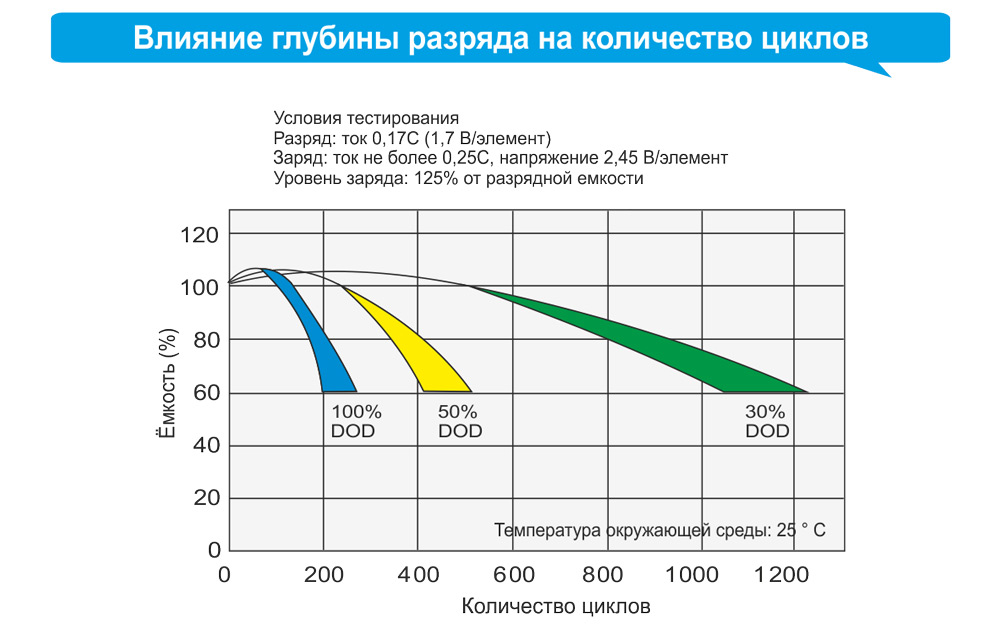
- жизненный цикл относительно небольшой, ограничен максимум 500-1000 циклами зарядки-разряда;
- нельзя допускать длительное хранение в разряженном состоянии – такая АКБ с большой вероятностью станет непригодной для использования;
- для кислотно-свинцовой батареи перезаряд столь же вреден, как и глубокая разрядка.
Если какие-то характеристики и удаётся улучшить, то за счёт ухудшения других, хотя положительные подвижки всё же происходят.
Сфера применения
Было бы неправильным считать, что свинцово-кислотные аккумуляторы используются исключительно в автомобильной отрасли. Да, по количественным показателям именно автомобильные батареи являются несомненными лидерами. Но они успешно применяются и в других сферах:
- при производстве осветительного оборудования;
- в качестве аварийных источников электроснабжения;
- в охранных системах, для обеспечения питанием сигнализаций;
- для приборов КИП;
- ими снабжаются бытовые и промышленные ИБП;
- такие батареи устанавливаются в детские автомобили, инвалидные коляски.
В заключение можно уверенно заявить, что АКБ этого типа не скоро уйдут «в тираж»: их востребованность обусловлена простотой конструкции, невысокой стоимостью, высокой ёмкостью, небольшой величине внутреннего сопротивления и, как следствие, невысокому уровню саморазряда.
Источник