- Чем отличается аккумулятор от гальванического элемента
- Чем отличается аккумулятор от гальванического элемента
- Что такое гальванический элемент?
- Что такое аккумулятор?
- Гальванические элементы и аккумуляторы — устройство, принцип работы, виды
- Особенности гальванических элементов
- Что это такое
- Источник токов
- Щелочные батареи
- Солевые ячейки
- Литиевые аккумуляторы
- Устройство гальванического элемента
- Принцип работы
- Область использования
Чем отличается аккумулятор от гальванического элемента
Чем отличается аккумулятор от гальванического элемента
Главная разница между гальваническим элементом и аккумулятором в том, что первый одноразовый в использовании, а аккумуляторы через способность накапливать энергию циклически, можно использовать далеко не один раз.
Аккумулятор использует обратимую электрохимическую реакцию, а гальванический элемент необратимую (в основном) . Если аккумулятор сконструирован таким образом, чтоб была возможность рассеивать значительную мощность при его зарядке, то зарядка батарейки может привести к взрыву.
Что такое гальванический элемент?
Гальванический элемент — это химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Назван в честь Луиджи Гальвани. Переход химической энергии в электрическую энергию происходит в гальванических элементах.
Гальванические элементы представляют собой источники тока, которые не способны восстанавливать запас электрической энергии самостоятельно или вообще. Например, таким элементом являются обычные батарейки.
Что такое аккумулятор?
Аккумулятор — устройство для накопления энергии с целью её последующего использования.
В своем точном значении, аккумулятор — элементслово аккумулятор обозначает вторичный (заряжаемый) химический источник тока, т.е. один гальванический элемент, допускающий повторную зарядку.
Источник
Гальванические элементы и аккумуляторы — устройство, принцип работы, виды
Маломощные источники электрической энергии
Для питания переносной электро- и радиоаппаратуры применяют гальванические элементы и аккумуляторы.
Гальванические элементы — это источники одноразового действия, аккумуляторы — источники многоразового действия.
Простейший гальванические элемент
Простейший элемент может быть изготовлен из двух полосок: медной и цинковой, погруженных в воду, слегка подкисленную серной кислотой. Если цинк достаточно чист, чтобы быть свободным от местных реакций, никаких заметных изменений не произойдет до тех пор, пока медь и цинк не будут соединены проводом.
Однако полоски имеют разные потенциалы одна по отношению к другой, и когда они будут соединены проводом, в нем появится электрический ток. По мере этого действия цинковая полоска будет постепенно растворяться, а близ медного электрода будут образовываться пузырьки газа, собирающиеся на его поверхности. Этот газ — водород, образующийся из электролита. Электрический ток идет от медной полоски по проводу к цинковой полоске, а от нее через электролит обратно к меди.
Постепенно серная кислота электролита замещается сульфатом цинка, образующимся из растворенной части цинкового электрода. Благодаря этому напряжение элемента уменьшается. Однако еще более сильное падение напряжения вызывается образованием газовых пузырьков на меди. Оба эти действия производят «поляризацию». Подобные элементы не имеют почти никакого практического значения.
Важные параметры гальванических элементов
Величина напряжения, даваемого гальваническими элементами, зависит только от их типа и устройства, т. е. от материала электродов и химического состава электролита, но не зависит от формы и размеров элементов.
Сила тока, которую может давать гальванический элемент, ограничивается его внутренним сопротивлением.
Очень важной характеристикой гальванического элемента является электрическая емкость. Под электрической емкостью подразумевается то количество электричества, которое гальванический или аккумуляторный элемент способен отдать в течение всего времени своей работы, т. е. до наступления окончательного разряда.
Отданная элементом емкость определяется умножением силы разрядного тока, выраженной в амперах, на время в часах, в течение которого разряжался элемент вплоть до наступления полного разряда. Поэтому электрическая емкость выражается всегда в ампер-часах (А х ч).
По величине емкости элемента можно также заранее определить, сколько примерно часов он будет работать до наступления полного разряда. Для этого нужно емкость разделить на допустимую для этого элемента силу разрядного тока.
Однако электрическая емкость не является величиной строго постоянной. Она изменяется в довольно больших пределах в зависимости от условий (режима) работы элемента и конечною разрядного напряжения.
Если элемент разряжать предельной силой тока и притом без перерывов, то он отдаст значительно меньшую емкость. Наоборот, при разряде того же элемента током меньшей силы и с частыми и сравнительно продолжительными перерывами элемент отдаст полную емкость.
Что же касается влияния на емкость элемента конечного разрядного напряжения, то нужно иметь в виду, что в процессе разряда гальванического элемента его рабочее напряжение не остается на одном уровне, а постепенно понижается.
Распространенные виды гальванических элементов
Наиболее распространены гальванические элементы марганцево-цинковой, марганцево-воздушной, воздушно-цинковой и ртутно-цинковой систем с солевым и щелочным электролитами. Сухие марганцево-цинковые элементы с солевым электролитом имеют начальное напряжение от 1,4 до 1,55 В, продолжительность работы при температуре окружающей среды от -20 до -60 о С от 7 ч до 340 ч.
Сухие марганцево-цинковые и воздушно-цинковые элементы со щелочным электролитом имеют напряжение от 0,75 до 0,9 В и продолжительность работы от 6 ч до 45 ч.
Сухие ртутно-цинковые элементы имеют начальное напряжение от 1,22 до 1,25 В и продолжительность работы от 24 ч до 55 ч.
Наибольший гарантийный срок хранения, достигающий 30 месяцев, имеют сухие ртутно-цинковые элементы.
Аккумуляторы — это вторичные гальванические элементы. В отличие от гальванических элементов в аккумуляторе же сразу после сборки никакие химические процессы не возникают.
Чтобы в аккумуляторе начались химические реакции, связанные с движением электрических зарядов, нужно соответствующим образом изменить химический состав его электродов (а частью и электролита). Это изменение химического состава электродов происходит под действием пропускаемого через аккумулятор электрического тока.
Поэтому, чтобы аккумулятор мог давать электрический ток, его предварительно нужно «зарядить» постоянным электрическим током от какого-нибудь постороннего источника тока.
От обычных гальванических элементов аккумуляторы выгодно отличаются также тем, что после разряда они опять могут быть заряжены. При хорошем уходе за ними и при нормальных условиях эксплуатации аккумуляторы выдерживают до нескольких тысяч зарядов и разрядок. 
В настоящее время наиболее часто на практике применяют свинцовые и кадмиево-никелевые аккумуляторы. У первых электролитом служит раствор серной кислоты, а у вторых — раствор щелочей в воде. Свинцовые аккумуляторы называют также кислотными, а кадмиево-никелевые — щелочными.
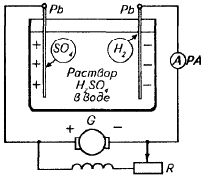
Принцип работы аккумуляторов основан на поляризации электродов при электролизе. Простейший кислотный аккумулятор устроен следующим образом: это две свинцовые пластины, опущенные в электролит. В результате химической реакции замещения пластины покрываются слабым налетом сернокислого свинца PbSO4, как это следует из формулы Pb + H2SO4 = PbSO4 + Н2.
Устройство кислотного аккумулятора
Такое состояние пластин соответствует разряженному аккумулятору. Если теперь аккумулятор включить на заряд, т. е. подсоединить его к генератору постоянного тока, то в нем вследствие электролиза начнется поляризация пластин. В результате заряда аккумулятора его пластины поляризуются, т. е. изменяют вещество своей поверхности, и из однородных (PbSO4) превращаются в разнородные (Pb и Р b О 2 ).
Аккумулятор становится источником тока, причем положительным электродом у него служит пластина, покрытая двуокисью свинца, а отрицательным — чистая свинцовая пластина.
К концу заряда концентрация электролита повышается вследствие появления в нем дополнительных молекул серной кислоты.
В этом одна из особенностей свинцового аккумулятора: его электролит не остается нейтральным и сам участвует в химических реакциях при работе аккумулятора.
Как зарядить аккумулятор
Существует несколько способов заряда аккумуляторов. Наиболее простой — нормальный заряд аккумулятора, который происходит следующим образом. Вначале на протяжении 5 — 6 ч заряд ведут двойным нормальным током, пока напряжение на каждой аккумуляторной банке не достигнет 2,4 В.
Нормальный зарядный ток определяют по формуле I зар = Q/16
где Q — номинальная емкость аккумулятора, Ач.
После этого зарядный ток уменьшают до нормального значения и продолжают заряд и течение 15 — 18 ч, до появления признаков конца заряда.
Кадмиево-никелевые, или щелочные аккумуляторы, появились значительно позже свинцовых и по сравнению с ними представляют собой более совершенные химические источники тока. Главное преимущество щелочных аккумуляторов перед свинцовыми заключается в химической нейтральности их электролита по отношению к активным массам пластин. Благодаря этому саморазряд у щелочных аккумуляторов получается значительно меньше, чем у свинцовых. Принцип действия щелочных аккумуляторов также основан на поляризации электродов при электролизе.
Для питания радиоаппаратуры выпускают герметичные кадмиево-никелевые аккумуляторы, которые работоспособны при температурах от -30 до +50 о С и выдерживают 400 — 600 циклов заряд-разряд. Эти аккумуляторы выполняют в форме компактных параллелепипедов и дисков с массой от нескольких граммов до килограммов.
Выпускают никель-водородные аккумуляторы для энергоснабжения автономных объектов. Удельная энергия никель-водородного аккумулятора составляет 50 — 60 Вт ч кг -1 .
Если Вам понравилась эта статья, поделитесь ссылкой на неё в социальных сетях. Это сильно поможет развитию нашего сайта!
Не пропустите обновления, подпишитесь на наши соцсети:
Источник
Особенности гальванических элементов
Время на чтение:
Люди довольно часто сталкиваются с электрохимическими элементами в повседневной жизни: от одноразовых батареек АА в пультах дистанционного управления ТВ до литий-ионных батарей в смартфонах. Существует два типа таких ячеек: гальванические и электролитические. Первые получают свою энергию от самопроизвольных окислительно-восстановительных реакций (ОВР), в то время как вторые требуют внешний источник электронов, например, блока питания переменного тока. Оба элемента состоят из анода (А) и катода (К), изготавливаемых из разнородных металлов и электролитов.
Что это такое
В любом электрохимическом процессе электроны переходят из одного вещества в другое, что обусловлено ОВР. Восстановитель представляет собой вещество, которое теряет электроны и в процессе окисляется. Связанная энергия определяется разностью потенциалов между валентными электронами в атомах различных элементов.

Гальванический элемент — это устройство, которое преобразует химическую энергию в электрическую, используя электрохимию, а в быту называется батареей.
В такой ячейке есть контейнер, в котором содержится раствор концентрированного сульфата меди (CuSO4), а внутри раствора вставлен медный стержень — катод. Внутри контейнера находится пористый сосуд, заполненный концентрированной серной кислота (H2SO4), в нее вставлен цинковый стержень — анод. Таким образом, когда провод соединяет медный и цинковый стержни, по нему начинает протекать электрический ток.
Дополнительная информация. Реакции окисления и восстановления разделяются на части, называемые полуреакциями. Внешняя цепь используется для проведения потока электронов между электродами гальванического элемента. Электроды изготавливают из любых проводящих материалов, таких как металлы, полупроводники, графит и даже полимеры.
Источник токов
Существует два типа электрохимических элементов: гальванические и электролитические. Гальваническая клетка использует энергию, выделяемую во время спонтанной окислительно-восстановительной реакции для выработки электроэнергии.
Электролитическая ячейка потребляет энергию от внешнего источника, используя ее, чтобы вызвать непредвиденную окислительно-восстановительную реакцию.

Гальванический элемент, история создания которого официально началась в 18 веке, дал старт развития науки электротехники. Во время проведения экспериментов с электричеством в 1749 году Бенджамин Франклин впервые ввел термин «батарея» для описания связанных конденсаторов. Однако его устройство не стала первой ячейкой. Находки археологов «батареи Багдада» в 1936 году имеют возраст более 2000 лет, хотя точное назначение их до сих пор спорно.
Луиджи Гальвани в честь которого названа гальваническая ячейка, впервые описал «электричество животных» в 1780 году, когда пропускал ток через лягушку. В то время он не знал об этом, но его устройство работало по принципу батареи. Его современник Алессандро Вольта в честь которого названа «вольтовая ячейка» был убежден, что «животное электричество» исходило не от лягушки, а от чего-то другого, он много работал над этим и в 1800 году изобрел первую настоящую батарею — «вольтовую кучу».

В 1836 году Джон Фредерик Даниэль, исследуя способы преодоления проблем вольтовой кучи создал свою ячейку. За этим открытием последовало создание ячейки Уильяма Роберта Гроува в 1844 году. Первая аккумуляторная батарея была изготовлена из свинцово-кислотного элемента в 1859 году компанией Gaston Plante, далее появились гравитационная ячейка Калло в 1860 и ячейка Лекланш Жоржа Лекланша в 1866 году.
До этого момента все батареи были мокрого типа. В 1887 году Карл Гасснер создал первую сухую батарею, изготовленную из углеродно-цинковой батареи. Никель-кадмиевая батарея была представлена в 1899 году Вальдмаром Юнгнером вместе с никель-железной батареей. Однако Юнгнер не смог запатентовать ее и в 1903 году изобретатель Томас Эдисон запатентовал свой слегка измененный дизайн.
Русский ученый-физик Василий Петров в 1802 году соорудил крупнейшую гальваническую батарею в мире, дающую напряжение 1500В. Для сооружения потребовалось около 4200 цилиндров из меди и цинка с диаметром 35.0 мм м толщиной 2.5 мм. Батарея была размещена в ящике из красного дерева, обработанного несколькими слоями различных смол. Опыты Петрова положили начало современной электрометаллургии в дуговых печах.
Обратите внимание! Крупный прорыв в гальваническом направлении источников тока произошел в 1955 году, когда Льюис Урри, сотрудник компании «Energizer», представил общую щелочную батарею. 1970-е годы привели к никель-водородной батарее, а 1980-е годы к никель-металлогидридной батарее.
Литиевые батареи были впервые созданы еще в 1912 году, однако наиболее успешный тип, литий-ионный полимерный аккумулятор, используемый сегодня в большинстве портативных электронных устройств, был выпущен только в 1996 году.
Гальванические элементы классифицируются, как щелочные и нещелочные. Стандартная щелочная сухая батарея имеет цинковый А и К из диоксида марганца. Электролит выполнен в виде некислотной пасты. Обычно электролитом, используемым в щелочных батарейках — есть гидроксид калия. Она выполнена в форме стальной банки, заполненной диоксидом марганца в самой внутренней области К, и заполнена цинком и электролитом в центральной области А. Электролит, окружающий А, запускает химреакцию между ними.

Типичная нещелочная батарея с сухими элементами имеет цинковый А и К из углеродного стержня/ диоксида марганца. Электролит обычно представляет собой кислое пастообразное вещество из смеси хлорида аммония и хлорида цинка. Физически она имеет обратную щелочной батареи конструкцию. Цинковый контейнер служит внешним анодом, тогда как углеродный стержень/ диоксид марганца занимает внутреннюю область в качестве К. Электролит смешивается с К и обеспечивает химическую реакцию между К и А.
Общее мнение специалистов говорит о том, что химически щелочная батарея имеет преимущества по отношению к нещелочной. Хотя последние более надежные и дешевые, тем не менее, щелочные, нужны, когда требуется быстрое, сильнотоковое потребление, например, вспышка на камере с быстрой перезарядкой.
Щелочные батареи
Эта конструкция ячейки получила свое название благодаря использованию щелочных водных растворов в качестве электролитов. Химия щелочных устройств была впервые введена в начале 60-х годов. И сразу стала крупнейшим конкурентом цинк-углеродной ячейки. Эти элементы обладают многими признанными преимуществами по сравнению с цинк-углеродом, включая более высокую плотность энергии, длительный срок хранения, превосходное сопротивление утечке, лучшие характеристики, как в непрерывном, так и в прерывистых рабочих циклах, и более низкое внутреннее сопротивление, что позволяет им работать при высоких скоростях разряда.

Цинк в порошкообразной форме увеличивает площадь поверхности анода, что обеспечивает большее взаимодействие частиц. Это снижает внутреннее сопротивление и увеличивает плотность мощности. Катод, MnO2, произведен синтетически из-за его превосходства над природным MnO2, что дает рост плотности энергии. Как и в цинковой в углеродной ячейке, графит добавляется к катоду для увеличения проводимости.
Электролит КОН, обеспечивает высокую ионную проводимость. Оксид цинка часто включают для замедления коррозии цинкового анода. Производное от целлюлозы и гелеобразующего агента делают щелочной элемент более дорогим, чем цинк-углерод, но более экономичным, особенно в ситуациях с высоким расходом, когда плотность энергии щелочного элемента намного выше.
- Zn + 2OH — -> ZnO + H2O + 2 e —
- 2MnO2 + H2O + 2 e — -> Mn2O 3 + 2OH —
- Zn + 2MnO2 -> ZnO + Mn2O3 E = 1,5 В
Существуют и другие конструкции ячеек, которые относятся к категории щелочных, в том числе оксиды ртути, серебра и цинка. Ртуть и серебро дают еще более высокую плотность энергии, но стоят намного дороже и постепенно исключаются требованиями международных организаций из-за их высокой токсичности.
Солевые ячейки
Аккумуляторы с сухими элементами — это устройства, в которых используется электролит с очень низким содержанием влаги. Они контрастируют с батареями с мокрыми элементами, такими как свинцово-кислотные, в которых используется жидкий электролит. Электролит, используемый в большинстве устройств с сухими элементами, является пастой, которая, хотя и содержит влагу, тем не менее остается относительно сухой. Наиболее часто используемые формы сухих элементов — это батареи типа «С», «А», 9 вольт батарейки и для электронных часов.

Важно! Сухих элементы вырабатывают электроэнергию путем преобразования химической энергии в электричество. Выходные данные зависят от типа батареи с сухими элементами. Более популярными являются конструкции с использованием цинка и углерода или цинка и диоксида марганца.
Эти материалы помещаются в пасту электролита внутри батареи. Они реагируют друг с другом посредством химического процесса, в котором электролит, диоксид углерода или марганца реагирует с цинком, создавая электричество.
Литиевые аккумуляторы
Литий-ионная технология включает в себя несколько химических процессов: ионы лития хранятся в аноде или отрицательном электроде, и транспортируются во время разряда к катоду или положительному электроду в органическом электролите.
Наиболее популярными материалами являются графит для анода и оксид металла для катода на основе никеля, марганца и кобальта. Все эти материалы обладают хорошими свойствами интеркалирования лития, что позволяет хранить большое количество энергии.

Выбор аккумуляторной технологии зависит от требований эксплуатации по производительности, сроку службы, безопасности и стоимости, причем каждый тип аккумулятора обеспечивает определенные функциональные возможности.
Преимущества литий-ионных аккумуляторов:
- Высокая плотность энергии. Высокая плотность энергии является одним из главных преимуществ технологии литиевых батарей, для того чтобы работать дольше.
- Саморазряд. Одной из проблем многих аккумуляторов является скорость саморазряда. Литий-ионные элементы в том, что скорость их саморазряда намного ниже, чем у Ni-Cad и NiMH. Обычно составляет около 5% в первые 4 часа после зарядки, но затем падает до 1 или 2% в месяц.
- Низкие эксплуатационные расходы, поскольку требуют технического обслуживания для обеспечения их производительности.
- Разнообразие типов: для бытовой электроники, для электроинструментов и электромобилей.
У таких батарей есть один существенный недостаток — им требуется встроенная схема защиты. Кроме того они страдают от старения и могут выдержать 500–1000 циклов зарядки-разрядки.
Устройство гальванического элемента
Гальваническая ячейка представляет собой простое устройство, с помощью которого химическая энергия преобразуется в электрическую энергию.
Строение гальванического элемента для литиевых батарей:
- Анод, при разряде отдает электроны во внешнюю цепь и окисляется во время электрохимической реакции. Большинство коммерческих элементов в настоящее время используют электрод на основе углерода/графита, однако можно использовать металл или сплав.
- Катод, на разряде принимает электроны из внешней цепи и восстанавливается во время электрохимической реакции. Обычно это переходный металлический оксид или фосфат.
- Электролит.
Обратите внимание! Строение электролита ионный проводник, при этом электронный изолятор, разделяет два электрода и обеспечивает среду для переноса заряда внутри ячейки между анодом и катодом. Электролитом обычно является неводный неорганический растворитель, содержащий растворенную соль лития, например LiPF6 в пропиленкарбонате.
Принцип работы
Литиевая батарея известна как «электронный насос» из-за носителей заряда, перемещающихся между двумя электродами во время зарядки и разрядки. Электрическое (насосное) давление или разность потенциалов между положительной и отрицательной клеммами называется напряжением или электродвижущей силой (ЭДС). Свободная энергия, связанная с переносом электронов вокруг внешней цепи и ионов лития между двумя интеркалирующими электродами, связана с разницей в химическом потенциале лития в двух электродах.
Элементы батареи накапливают энергию химически в своих электроактивных материалах. Эта химическая энергия преобразуется в электрическую энергию по требованию, посредством электрохимической реакции окисления-восстановления.

Клетки построены в разряженном состоянии. При зарядке положительный электрод, катод, материал окисляется, ионы Li + де-интеркалируются из слоистого интеркалирующего литиевого источника, например LiCoO2, проходят через электролит.
Когда элемент разряжается, на отрицательном электроде происходит реакция окисления, ионы Li + де-интеркалируются из анода и мигрируют через электролит, чтобы быть повторно интеркалированными в материал катода. Одновременная реакция электрохимического восстановления протекает на положительном электроде и принимает электроны из внешнего контура, ионы Li + из электролита, чтобы преобразовать исходный материал. Переход от электронного тока к ионному току происходит на границе раздела электрод/электролит.
- Реакция восстановления положительного электрода (катода): Li 1 -xCoO 2 + xLi + + xe- → LiCoO2
- Реакция окисления отрицательного электрода (анода): LiC 6 → xLi + + xC6 + e-
- Общая обратимая, окислительно-восстановительная, клеточная реакция: LiC 6 + CoO 2 C6 + LiCoO 2

Область использования
Электрохимия имеет множество важных применений, особенно в промышленности. Ее процессы используются для изготовления электрических батарей. Они имеют множество применений, включая:
- Топливный элемент преобразует химическую потенциальную энергию, получаемую при окислении топлива, например, газа, водорода, углеводородов, спиртов в электрическую энергию.
- Различные виды пьезозажигалок для газа.
- Электрические приборы, такие как мобильные телефоны.
- Цифровые камеры-литиевые.
- Слуховые аппараты (оксидно-серебряные).
- Электронные часы (ртутные/оксидно-серебряные).
- Военные источники тока (тепловые).
- Батарейки A, AA, AAA, D, C и другие.
Использование химических реакций для производства электричества в настоящее время является приоритетом для многих исследователей. Возможность адекватно использовать химические реакции в качестве источника энергии в значительной степени поможет решить проблемы загрязнения окружающей среды.
Источник